题目内容
15.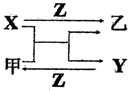 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )| A. | X、Y、Z一定都是非金属单质 | B. | X、Y、Z一定都是金属单质 | ||
| C. | X、Y、Z中至少有一种是非金属单质 | D. | X、Y、Z中至少有一种是金属单质 |
分析 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,甲+X=Y+乙是置换反应,X+Z=乙是化合反应,Y+Z=甲是化合反应,X可能是氢气或者碳或者活泼金属,x和z会生成乙,y和z会生成甲,金属和酸生成盐和氢气,所以X是氢气或碳或镁等进行分析.
解答 解:A.X可以是金属,如为Al,Mg等,Al+HCl→AlCl3+H2,Z为Cl2;Mg+CO2→C+MgO,Z为O2;Al+Fe2O3→Al2O3+Fe,Z为O2;都可以符合转化关系,故A错误;
B.X、Y、Z不一定都为金属,例如X、Y可以为非金属单质,Z可以是非金属单质,如:C+SiO2→Si+CO,Z为O2,故B错误;
C.若X、Y为金属单质,是金属间的置换反应,所以化合物一定是金属的非金属化合物,所以Z必为非金属单质,故C正确;
D.X、Y、Z可以全部为非金属单质,如:C+SiO2→Si+CO,Z为O2,故D错误;
故选C.
点评 本题考查了常见置换反应的特征性质,主要考查常见各种类型的置换反应,金属置换金属,金属置换非金属,非金属置换非金属,非金属置换金属等类型的反应,关键是知识的熟练程度.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
12.能在水溶液中大量共存的离子组是( )
| A. | H+、Fe3+、ClO-、Cl- | B. | H+、NH4+、Fe2+、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、OH- |
6.设NA为阿伏加徳罗常数的值.下列说法正确的是( )
| A. | O.1molNa2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24LCl2含孤电子对的数目为0.2NA | |
| C. | PH=2的H2SO4溶液中含H+的数目为0.12NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
3.常温下用惰性电极电解1L含足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)( )
| A. | pH=n | B. | pH=-lg n | C. | pH=14-lgn | D. | pH=lgn+14 |
10.如图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
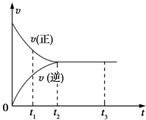

| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
20.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 23g由NO2和N2O4组成的混合气体中含有的氮原子数为0.5NA | |
| B. | 1.12L乙烯能与含0.05NA个溴分子的CCl4溶液恰好完全反应 | |
| C. | 1L0.1mol•L-1Fe2(SO4)3溶液中,Fe3+的数目为0.2NA | |
| D. | 7.8gNa2O2与水完全反应时转移的电子数为0.2NA |
7.我国是世界最大的耗煤国家,下列加工方法不属于煤的综合利用的是( )
| A. | 干馏 | B. | 气化 | C. | 液化 | D. | 裂解 |
4.常温常压,将7.8g的Na2O2加入足量的1H218O中,反应完全后,有关物质的物理量正确的是( )
| A. | 转移的电子数是0.1NA | B. | 反应后液体质量减少1.6g | ||
| C. | 生成的气体中含有0.8mol中子 | D. | 生成气体的体积是1.12L |
5.短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,Y原子的最外层电子数是其电子层数的2倍,在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,W的氢化物能与Z的某种氢化物反应生成Z的另外一种氢化物和W单质.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | W单质易溶于化合物YW2 | |
| C. | 氢化物的稳定性和沸点均是Z>W | |
| D. | X单质在加热的条件下与Z的某种单质反应生成X2Z2 |