题目内容
6.设NA为阿伏加徳罗常数的值.下列说法正确的是( )| A. | O.1molNa2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24LCl2含孤电子对的数目为0.2NA | |
| C. | PH=2的H2SO4溶液中含H+的数目为0.12NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
分析 A、过氧化钠与水反应是自身氧化还原反应,氧元素化合价-1价变化为0价和-2价;
B、气体物质的量n=$\frac{V}{22.4}$,氯气中氯原子形成一对共用电子对,每个氯原子含有3对孤对电子;
C、溶液体积不知不能计算微粒数;
D、氨水中除一水合氨含有氢原子,水中也含氢原子.
解答 解:A、过氧化钠与水反应是自身氧化还原反应,氧元素化合价-1价变化为0价和-2价,O.1molNa2O2与水反应转移电子数目为0.1NA,故A正确;
B、气体物质的量n=$\frac{V}{22.4}$=$\frac{2.24L}{22.4L/mol}$=0.1mol,氯气中氯原子形成一对共用电子对,每个氯原子含有3对孤对电子,标况下,2.24LCl2含孤电子对的数目为0.6NA,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、氨水中除一水合氨含有氢原子,水中也含氢原子,在10g质量分数为17%的氨水中,氨气=10g×17%=1.7g,物质的量=$\frac{1.7g}{17g/mol}$=0.1mol,含有H的数目大于0.3NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析,物质的量计算微粒数方法,注意溶液中溶质和溶剂的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
3.已知烯烃在一定条件下可以发生如下反应:2RCH=CHR′→RCH=CHR+R′CH=CHR′(R、R′都表示烃基)
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
该反应称为烯烃复分解反应,2005年诺贝尔化学奖就授予研究该反应的几位科学家.下列对该反应机理的猜测肯定不正确的是( )
| A. | 反应物分子都断裂C=C键 | |
| B. | 反应物分子都断裂R-C键 | |
| C. | 反应物分子都断裂R′-C键 | |
| D. | 两分子反应物中,一个断裂R-C键,另一个断裂R′-C键 |
4.依据下列实验现象,得出的结论正确的是( )
| 操作 | 实验现象 | 结论 | |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |
14.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中的空间构型为正四面体形 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
1.室温时,浓度均为0.1mol•L-1的三种酸HX、HY、HZ,稀释时的pH变化如图所示.下列判断正确的是( )


| A. | 等体积的三种酸与足量Mg反应,HX放出气体的体积最小 | |
| B. | 三种酸等体积混合后与NaOH溶液反应,当HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| C. | 根据曲线,可得0.1mol•L-1HX溶液中由水电离出的c(H+)为10-4mol•L-1 | |
| D. | 将HY与HZ的稀溶液混合后所得溶液中:c(H+)=$\frac{{K}_{a}(HY)•c(HY)}{c({H}^{+})}$+c(Z-)+c(OH-) |
18.中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金.下列关于这三个工业生产的描述中正确的是( )
| A. | 电解精炼铜时,负极反应式:Cu2++2e-=Cu | |
| B. | 氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 | |
| C. | 在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生 | |
| D. | 电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液 |
15.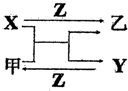 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )| A. | X、Y、Z一定都是非金属单质 | B. | X、Y、Z一定都是金属单质 | ||
| C. | X、Y、Z中至少有一种是非金属单质 | D. | X、Y、Z中至少有一种是金属单质 |
16.X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14.下列说法正确的是( )
| A. | 原子半径由大到小的顺序是Z>W>Y>X | |
| B. | 元素的非金属性W>Y>X | |
| C. | Z2Y3、WX分别是离子化合物、共价化合物 | |
| D. | X、Z、W的最高价氧化物都是酸性氧化物 |
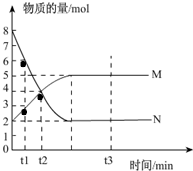 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: