题目内容
5.短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,Y原子的最外层电子数是其电子层数的2倍,在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,W的氢化物能与Z的某种氢化物反应生成Z的另外一种氢化物和W单质.下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | W单质易溶于化合物YW2 | |
| C. | 氢化物的稳定性和沸点均是Z>W | |
| D. | X单质在加热的条件下与Z的某种单质反应生成X2Z2 |
分析 短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,则X为Li元素;在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,则Z为O元素;Y原子的最外层电子数是其电子层数的2倍,而且原子序数比O小,则其电子排布为2、4,所以Y为C元素;W的氢化物能与O的某种氢化物反应生成O的另外一种氢化物和W单质,则反应为:H2O2+H2S=S↓+2H2O,所以W为S元素,据此分析.
解答 解:短周期元素X、Y、Z和W的原子序数依次增大,元素X是一种最轻的金属,则X为Li元素;在中学范围内Z的单质只有氧化性,且是空气的主要成分之一,则Z为O元素;Y原子的最外层电子数是其电子层数的2倍,而且原子序数比O小,则其电子排布为2、4,所以Y为C元素;W的氢化物能与O的某种氢化物反应生成O的另外一种氢化物和W单质,则反应为:H2O2+H2S=S+2H2O,所以W为S元素;
A.同一周期从左到右原子半径依次增大,电子层数越多半径越大,则原子半径:S>Li>C>O,即W>X>Y>Z,故A错误;
B.S单质易溶于化合物CS2,故B正确;
C.同主族从上到下,氢化物的稳定性增强,则氢化物的稳定性:H2O>H2S,由于水分子间存在氢键沸点较高,所以沸点:H2O>H2S,故C正确;
D.Li在氧气中燃烧只生成氧化物,即Li2O,故D错误.
故选BC.
点评 本题考查原子结构与元素周期律的关系,题目侧重于原子结构与元素周期律的递变规律的考查,注意根据原子结构特点明确元素的种类为解答该题的关键,题目难度中等.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
15.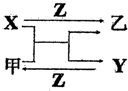 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是( )| A. | X、Y、Z一定都是非金属单质 | B. | X、Y、Z一定都是金属单质 | ||
| C. | X、Y、Z中至少有一种是非金属单质 | D. | X、Y、Z中至少有一种是金属单质 |
16.X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14.下列说法正确的是( )
| A. | 原子半径由大到小的顺序是Z>W>Y>X | |
| B. | 元素的非金属性W>Y>X | |
| C. | Z2Y3、WX分别是离子化合物、共价化合物 | |
| D. | X、Z、W的最高价氧化物都是酸性氧化物 |
13.正丁醛经催化加氢可制备1-丁醇.为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
粗品$→_{操作1}^{饱和NaHSO3溶液}$滤液$→_{萃取}^{乙醛}$操作2有机层$→_{操作3}^{固体干燥剂}$1-丁醇乙醚(操作4)纯品
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃.则操作1~4分别是( )
| A. | 萃取、过滤、蒸馏、蒸馏 | B. | 过滤、分液、蒸馏、萃取 | ||
| C. | 过滤、蒸馏、过滤、蒸馏 | D. | 过滤、分液、过滤、蒸馏 |
20. Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素的原子结构示意图为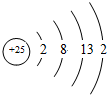 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
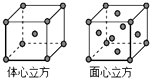
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素的原子结构示意图为
 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子都具备的结构特点是有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是sp,写出一种与CN-互为等电子体的单质分子的结构式N≡N;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚.丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(5)假设体心立方晶胞的铁原子半径为r,晶胞的边长为a,则该晶胞的空间利用率是68%.
10.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 乙烯和聚乙烯二者都能使溴的四氯化碳溶液褪色 | |
| C. | 化合物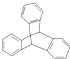 是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
17.最新报道,科学家又发现了某元素的一种原子,它的原子核内有161个中子,质量数为272.该元素的原子序数为( )
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
14.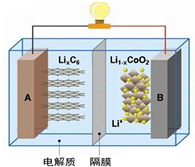 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
15.下列化合物,既能发生消去反应,又能发生催化氧化反应的是( )
| A. | CH3OH | B. | C2H5OH | C. | 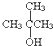 | D. | 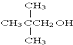 |