题目内容
【题目】镀作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
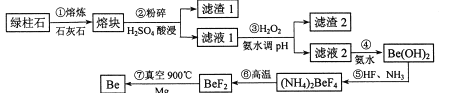
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:

(1)步骤②中将熔块粉碎的目的是_____________;滤渣1的主要成分是________。
(2)步骤③加入H2O2时发生反应的离子方程式为__________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是_____________。从溶液中得到(NH4)2BeF4的实验操作是_______、过滤、洗涤、干燥。
(4)步骤⑥的反应类型是_______,步骤⑦需要隔绝空气的环境,其原因是_____________。
(5)若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金_______t。
【答案】 增大与硫酸的接触面积,提高反应速率 H2SiO3 2Fe2++H2O2+2H+==2Fe3++2H2O C 过量的NaOH溶液会溶解Be(OH)2(或不易确保Be2+沉淀完全) 蒸发浓缩、冷却结晶 分解反应 高温下空气中的氮气、氧气都可与镁或铍反应,从而降低产率 1.8×10-3ab(或![]() )
)
【解析】(1)将熔块粉碎能增大与硫酸的接触面积,提高酸浸时的反应速率;SiO2与石灰石高温下反应生成硅酸钙,硅酸钙在用硫酸进行酸浸时生成H2SiO3沉淀。答案为:增大与硫酸的接触面积,提高反应速率 、H2SiO3
(2)步骤③中加入H2O2的目的是把Fe2+氧化为Fe3+,便于铁杂质的除去,发生反应的离子方程式为:2Fe2++H2O2+2H+==2Fe3++2H2O;从滤液1中得到的沉淀为Fe(OH)3、Al(OH)3,调节PH既要Fe3+和Al3+沉淀完全又不能使Be2+沉淀,根据几种金属阳离子的氢氧化物沉淀时的pH表可知,合理pH为5.0~5.2。
答案为:2Fe2++H2O2+2H+==2Fe3++2H2O 、 C
(3)Be和Al性质相似,用NaOH溶液来沉淀Be2+会导致Be(OH)2被溶解,不宜使用NaOH溶液来沉淀Be2+;对溶液进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可以得到(NH4)2BeF4 固体。答案为:过量的NaOH溶液会溶解Be(OH)2(或不易确保Be2+沉淀完全)、蒸发浓缩、冷却结晶
(4)步骤⑥中(NH4)2BeF4通过分解反应生成BeF2;步骤⑦中,空气中含有氮气和氧气,氮气和氧气都能与镁或铍发生反应,降低Be的产率。答案为:分解反应 、 高温下空气中的氮气、氧气都可与镁或铍反应,从而降低产率
(5)根据题知条件可得铍铜合金的质量=![]() =1.8×10-3ab(或
=1.8×10-3ab(或![]() )吨,答案为:1.8×10-3ab(或
)吨,答案为:1.8×10-3ab(或![]() )
)

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃