جâؤ؟ؤعبف
،¾جâؤ؟،؟¼×،¢ززء½³طµç¼«²ؤءد¶¼تاجْ°ôسëج¼°ô(بçح¼)،£ضî»ط´ًدآءذختجâ£؛

£¨1£©بôء½³طضذ¾ùت¢·إCuSO4بـز؛£¬·´س¦ز»¶خت±¼ن؛َ£؛
¢ظسذ؛ىة«خïضتخِ³ِµؤتا£؛¼×³طضذµؤ_____°ô£»زز³طضذµؤ____°ô،£
¢عشعزز³طضذرô¼«µؤµç¼«·´س¦تا____________،£
£¨2£©بôء½³طضذ¾ùت¢·إ±¥؛حNaClبـز؛،£
¢ظذ´³ِزز³طضذ×ـ·´س¦µؤہë×س·½³جت½£؛___________________،£
¢ع½«تھبَµؤµي·غKIتشض½·إشعزز³ط¸½½ü£¬·¢دضتشض½±نہ¶£¬´ز»¶خت±¼ن؛َسض·¢دضہ¶ة«حتب¥£¬صâتازٍخھ¹ء؟µؤCl2½«ةْ³ةµؤI2رُ»¯،£بô·´س¦µؤCl2؛حI2µؤخïضتµؤء؟ض®±بخھ5:1£¬ازةْ³ةء½ضضثل،£¸أ·´س¦µؤ»¯ر§·½³جت½خھ______________،£
،¾´ً°¸،؟ C Fe 4OH--4e-=2H2O+O2،ü 2C1-+2H2O![]() H2،ü+Cl2،ü+2OH- 5Cl2+I2+6H2O=10HCl+2HIO3
H2،ü+Cl2،ü+2OH- 5Cl2+I2+6H2O=10HCl+2HIO3
،¾½âخِ،؟£¨1£©¼×خھشµç³ط£¬Feخھ¸؛¼«£»ززخھµç½â³ط£¬سةµç×سء÷دٍ؟ةضھ£¬Cخھرô¼«£¬Feخھزُ¼«£¬حہë×سµأµ½µç×سةْ³ةCu£¬رô¼«ةداâرُ¸ùہë×س·إµç£»
£¨2£©زز³طتاµç½â³ط£¬سةµç×سء÷دٍ؟ةضھ£¬Cخھرô¼«£¬بـز؛ضذآبہë×ست§µç×س·¢ةْرُ»¯·´س¦ةْ³ةآبئّ£¬Feخھزُ¼«£¬بـز؛ضذاâہë×سµأµ½µç×س·¢ةْ»¹ش·´س¦ةْ³ةاâئّ£»¸ù¾فµأت§µç×ستدàµبب·¶¨ةْ³ةخشظ¸ù¾ف·´س¦خï؛حةْ³ةخïذ´³ِ·´س¦·½³جت½،£
£¨1£©¢ظ¼×خھشµç³ط£¬Feخھ¸؛¼«£¬ج¼خھص¼«£¬حہë×س·إµçخِ³ِح£¬ثùزشج¼µç¼«ةدةْ³ة؛ىة«خïضتCu£»ززخھµç½â³ط£¬سةµç×سء÷دٍ؟ةضھ£¬Feخھزُ¼«£¬حہë×سµأµ½µç×سةْ³ةCu£»
¢عشعزز³طضذرô¼«اâرُ¸ù·إµç£¬µç¼«·´س¦تا4OH--4e-=2H2O+O2،ü،£
£¨2£©¢ظزز³طتاµç½â³ط£¬سةµç×سء÷دٍ؟ةضھ£¬Cخھرô¼«£¬بـز؛ضذآبہë×ست§µç×س·¢ةْرُ»¯·´س¦ةْ³ةآبئّ£¬Feخھزُ¼«£¬بـز؛ضذاâہë×سµأµ½µç×س·¢ةْ»¹ش·´س¦ةْ³ةاâئّ£¬×ـ·´س¦ت½خھ2C1-+2H2O![]() H2،ü+Cl2،ü+2OH-£»
H2،ü+Cl2،ü+2OH-£»
¢ع¹ء؟Cl2½«ةْ³ةµؤI2رُ»¯£¬بôCl2؛حI2·´س¦ت±µؤخïضتµؤء؟ض®±بخھ5£؛1£¬²¢ازةْ³ةء½ضضثل£¬آبئّ±»»¹شةْ³ةآبہë×س£¬1molآبئّ±»»¹شµأµ½2molµç×س£¬¸ù¾فµأت§µç×ستدàµبضھ£¬؛¬µâµؤثلضذµâµؤ»¯؛د¼غتا+5¼غ£¬ثùزش؛¬µâµؤثلتاµâثل£¬¹تآبئّ؛حµâ،¢ث®·´س¦ةْ³ةرخثل؛حµâثل£¬·´س¦·½³جت½خھ5Cl2+I2+6H2O=10HCl+2HIO3،£

 أûذ£؟خجأدµءذ´ً°¸
أûذ£؟خجأدµءذ´ً°¸،¾جâؤ؟،؟CO2¼بتاخآتزئّجه£¬ز²تاضطزھµؤ»¯¹¤شءد£¬زشCO2خھشءد؟ة؛د³ة¶àضضسذ»ْخï،£
£¨1£©CO2؟ةسأسعةْ²ْ¼×´¼£¬زرضھ£؛2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ¦¤H=QkJ/mol،£ز»¶¨جُ¼دآ£¬°´²»ح¬µؤح¶ءد±بX(X=n(H2)/n(CO2))دٍؤ³بف»؟ة±نµؤ؛مر¹أـ±صبفئ÷ضذ³نبëCO2،¢H2£¬²âµأ²»ح¬ح¶ءد±بت±CO2µؤ×ھ»¯آتسëخآ¶بµؤ¹طدµبçح¼ثùت¾،£
CH2=CH2(g)+4H2O(g) ¦¤H=QkJ/mol،£ز»¶¨جُ¼دآ£¬°´²»ح¬µؤح¶ءد±بX(X=n(H2)/n(CO2))دٍؤ³بف»؟ة±نµؤ؛مر¹أـ±صبفئ÷ضذ³نبëCO2،¢H2£¬²âµأ²»ح¬ح¶ءد±بت±CO2µؤ×ھ»¯آتسëخآ¶بµؤ¹طدµبçح¼ثùت¾،£
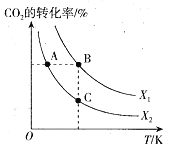
¢ظX1_______X2£¨جî،°>،±»ٍ،°<،±£¬؛َح¬£©£¬Q_______0،£
¢عح¼ضذA،¢B،¢Cبµم¶شس¦µؤئ½؛â³£تKA،¢KB،¢KCµؤ´َذ،¹طدµخھ______،£
¢غTKت±£¬شع¸أبف»؟ة±نµؤ؛مر¹أـ±صبفئ÷ضذ·¢ةْةدتِ·´س¦£¬²âµأسذ¹طت¾فبçدآ±يثùت¾£؛
خïضتµؤء؟(mol) ت±¼ن(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
زرضھشع10minت±ض»¸ؤ±نءثز»¸ِ·´س¦جُ¼£¬سأ¸ؤ±نµؤجُ¼؟ةؤـتا______،£
¢ـدآءذاé؟ِدآؤـ±يأ÷¸أ·´س¦´ïµ½ئ½؛â×´ج¬µؤتا_____،£
a.ئّجهأـ¶ب²»±ن b.»ى؛دئّذفµؤئ½¾ùؤ¦¶ûضتء؟²»±ن c.دû؛ؤثظآت£؛2v(H2O)=v(CO2)
£¨3£©³£خآدآ£¬سأNaOHبـز؛×÷CO2²¶×½¼ء²»½ِ؟ةزش½µµحج¼إإ·إ£¬¶ّاز؟ةµأµ½ضطزھµؤ»¯¹¤²ْئ·Na2CO3،£
¢ظ بôؤ³´خ²¶×½؛َµأµ½pH=10µؤبـز؛£¬شٍبـز؛ضذc(CO32-):c(HCO3-)=______ £غ³£خآدآK1(H2CO3)=4.4،ء10-7،¢K2(H2CO3)=5،ء10-11£ف،£
¢ع سûسأ5L Na2CO3بـز؛½«23.3 g BaSO4¹ججهب«¶¼×ھ»¯خھBaCO3£¬شٍثùسأµؤNa2CO3بـز؛µؤخïضتµؤء؟إ¨¶بضءةظخھ_________،£[زرضھ£؛³£خآدآKsp(BaSO4)=1،ء10-7،¢Ksp(BaCO3)=2.5،ء10-6]،££¨؛ِآشبـز؛جه»»µؤ±ن»¯£©
،¾جâؤ؟،؟خھ³ب¥ؤ³خïضتضذثù؛¬µؤشسضت£¬ضـ¼رأôح¬ر§×ِءثزشدآثؤ×éتµر飬ئنضذثثùر،سأµؤتش¼ء»ٍ²ظ×÷·½·¨صب·µؤتا£¨ £©
ذٍ؛إ | خïضت | شسضت | ³شستش¼ء»ٍ²ظ×÷·½·¨ |
¢ظ | NaClبـز؛ | Na2CO3 | ¼سبëرخثل£¬صô·¢ |
¢ع | FeSO4بـز؛ | CuSO4 | ¼سبë¹ء؟جْ·غ²¢¹آث |
¢غ | H2 | CO2 | زہ´خح¨¹ت¢سذNaOHبـز؛؛حإ¨ءٍثلµؤد´ئّئ؟ |
¢ـ | NaNO3 | CaCO3 | ¼سد،رخثلبـ½â،¢¹آث،¢صô·¢،¢½ل¾§ |
A.¢ظ¢ع¢غ
B.¢ع¢غ¢ـ
C.¢ظ¢غ¢ـ
D.¢ظ¢ع¢غ¢ـ
،¾جâؤ؟،؟شعز»¶¨جه»µؤأـ±صبفئ÷ضذ£¬½ّذذبçدآ»¯ر§·´س¦£؛CO2£¨g£©+H2£¨g£©CO£¨g£©+H2O£¨g£©£¬ئن»¯ر§ئ½؛â³£تK؛حخآ¶بtµؤ¹طدµبçدآ±ي£؛
t،و | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
»ط´ًدآءذختجâ£؛
£¨1£©¸أ·´س¦µؤ»¯ر§ئ½؛â³£ت±ي´ïت½خھ£»
£¨2£©·´س¦تا·´س¦£®£¨ر،جî،°خüبب،±،¢·إبب£©£®
£¨3£©ؤـإذ¶د¸أ·´س¦تا·ٌ´ïµ½»¯ر§ئ½؛â×´ج¬µؤزہ¾فتا £® a£®بفئ÷ضذر¹ا؟²»±ن b£®»ى؛دئّجهضذc£¨CO£©²»±ن
c£®vص£¨H2£©=vؤو£¨H2O£© d£®c£¨CO2£©=c£¨CO£©
£¨4£©ؤ³خآ¶بدآ£¬ئ½؛âإ¨¶ب·û؛ددآت½£؛c£¨CO2£©c£¨CH2£©=c£¨CO£©c£¨H2O£©£¬تشإذ¶د´ثت±µؤخآ¶بخھ،و