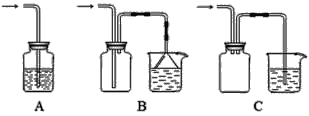
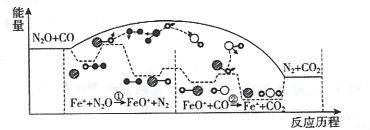
题目内容
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
【答案】250mL 21.6 C ③⑥ 不变 偏高 偏低 偏高
【解析】
(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL;
(2)浓盐酸的物质的量浓度为c=![]() ,根据溶液稀释定律C浓V浓=C稀V稀可计算盐酸体积;根据“大而近”的原则选择量筒;
,根据溶液稀释定律C浓V浓=C稀V稀可计算盐酸体积;根据“大而近”的原则选择量筒;
(3)溶液的配制中用到量筒、玻璃棒、259ml容量瓶、烧杯、台秤、胶头滴管、细口试剂瓶、标签纸;
(4)依据C=![]() 进行误差分析,分析不当操作对溶质的物质的量和溶液的体积的影响。
进行误差分析,分析不当操作对溶质的物质的量和溶液的体积的影响。
(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL,现在需要这种盐酸220mL,故应选用250mL容量瓶,故答案为:250;
(2)浓盐酸的物质的量浓度为c=![]() =
=![]() =11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×V×10—3L=1mol/L×250×10—3L,解得V=21.6mL;根据“大而近”的原则,根据需要量取的浓盐酸的体积为21.6mL来选择合适的量筒,应选择25mL量筒,故答案为:21.6;C;
=11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×V×10—3L=1mol/L×250×10—3L,解得V=21.6mL;根据“大而近”的原则,根据需要量取的浓盐酸的体积为21.6mL来选择合适的量筒,应选择25mL量筒,故答案为:21.6;C;
(3)由溶液的配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,溶液的配制中用到量筒、玻璃棒、259ml容量瓶、烧杯、台秤、胶头滴管、细口试剂瓶、标签纸,用不到药匙、台秤,故答案为:③⑥;
(4)①容量瓶中有少量蒸馏水,未干燥即将溶液转入,对溶质的物质的量和溶液的体积都不会产生影响,不影响溶液浓度,故答案为:不变;
②溶液未经冷却即注入容量瓶,冷却后溶液体积缩小,导致浓度偏高,故答案为:偏高;
③摇匀后,容量瓶的壁上会残留部分溶液,液面会低于刻度线,若再加水溶液体积增大,导致浓度偏低,故答案为:偏低;
④定容时俯视观察液面,导致溶液体积偏小,所配溶液浓度偏高,故答案为:偏高。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
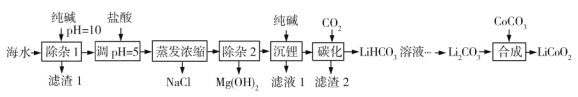
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。