题目内容
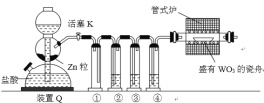
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
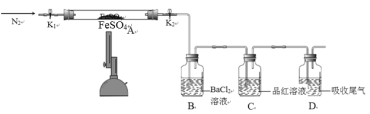
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
【答案】排尽装置内的空气,防止干扰实验 有白色沉淀生成 SO2 制作油漆或涂料 2FeSO4![]() Fe2O3 + SO2↑+SO3↑
Fe2O3 + SO2↑+SO3↑
【解析】
FeSO4易被空气中氧气氧化,需要在无氧环境中加热分解,所得固体产物红色粉末为Fe2O3,BaCl2溶液中有白色沉淀生成说明有SO3生成,品红褪色说明有SO2气体生成,结合电子守恒和原子守恒写出发生反应的化学方程式。
(1) 为避免亚铁被氧化,加热前通入N2的目的是排尽装置内的空气,防止干扰实验;
(2)实验过程中可观察到装置B中的现象为有白色沉淀生成,说明有SO3生成;C中观察到品红溶液褪色,则可证明混合气体中含有的物质是SO2;
(3)反应后A中残留红色粉末为Fe2O3,可制作油漆或涂料;
(4) 硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,方程式为2FeSO4![]() Fe2O3 + SO2↑+SO3↑。
Fe2O3 + SO2↑+SO3↑。

练习册系列答案
相关题目