��Ŀ����
����Ŀ�����̿����Ҫ�ɷ�ΪMnO2��������MgO��CaO��FeO��Fe2O3��Al2O3�����ʣ���ҵ�������̿���ȡMnSO4��H2O���������£�

��֪���� ���ֳ������������γ������������ʱ��pHֵ���±���
�������� | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
��ʼ����pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
��ȫ����pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
�� �¶ȸ���27��ʱ��MnSO4���ܽ�����¶ȵ����߶����͡�
��1����֪��25�桢101kpaʱ��
Mn(s)��O2(g)��MnO2(s) �� H����520 kJ/mol
S(s)��O2(g)��SO2(g) �� H����297 kJ/mol
Mn(s)��S(s)��2O2(g)��MnSO4(aq) �� H����1065 kJ/mol
��������������MnO2ת��ΪMnSO4���Ȼ�ѧ����ʽΪ___________________________��
��2�� ����1����������Ϊ�˳�ȥ����Һ�е�Fe3+��Fe2+��Al3+������H2O2��Һ��Ŀ���ǣ������ӷ���ʽ��ʾ��____________________________________________����Ҫ���ڵ�pH�ķ�Χ��_________________�����ӵ��Լ�X��_________ (�������������)��
A��MnO2 B��MnCO3 C��KMnO4 D��NaOH��
����ƽ���ƶ�ԭ������������X��ʹ��ȥ����Һ��Fe3+��ԭ���ǣ�_______________��
��3�������±����ݣ�ѡ������2�����������ӵ�����Y����һ�������Ӻ�һ����������ɣ�������Y�Ļ�ѧʽ____________��
������ Ksp ������ | CO32�� | F�� | OH�� |
Ca2+ | 5.0��10��9 | 1.5��10��10 | 4.7��10��6 |
Mg2+ | 3.8��10��6 | 7.4��10��11 | 5.6��10��12 |
Mn2+ | 2.2��10��11 | 5.3��10��3 | 2.1��10��13 |
��4��������ϵ�в���������Ҫ�����ȹ���������Ŀ����_______________________________��
��5����MnSO4��ҺΪԭ�ϣ����õ��ķ������Ʊ��ߴ��ȵ�MnO2������������ĵ缫��Ӧ����ʽΪ___________________________________________________________��
���𰸡�MnO2(s)��SO2(g) == MnSO4(aq) ��H= ��248kJ/mol-1��2Fe2++H2O2+2H+==2Fe3++2H2O5.2��pH��8.1B (MnCO3)��Һ����������ƽ�⣺Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+������MnCO3����H+��MnCO3��Ӧ��ʹ��Һ��c(H+)��С��ˮ��ƽ��������Fe(OH)3�ķ����ƶ����Ӷ���������MnF2��ֹ�¶��½�ʱMnSO4��H2O�ܽ������²��ʽ���Mn2+ - 2e- +2H2O��MnO2 + 4H+
Fe(OH)3 + 3H+������MnCO3����H+��MnCO3��Ӧ��ʹ��Һ��c(H+)��С��ˮ��ƽ��������Fe(OH)3�ķ����ƶ����Ӷ���������MnF2��ֹ�¶��½�ʱMnSO4��H2O�ܽ������²��ʽ���Mn2+ - 2e- +2H2O��MnO2 + 4H+
��������
��1���ɸ�˹���ɿ�֪MnO2ת��ΪMnSO4���Ȼ�ѧ����ʽ���ʱ���H=����1065 kJ/mol+520 kJ/mol+297 kJ/mol��=��248kJ/mol-1���ʴ�Ϊ��MnO2(s)��SO2(g) == MnSO4(aq) ��H= ��248kJ/mol-1����2���ɱ������ݿ�֪��Fe2+��ȫ����ʱ��Mn2+�ѿ�ʼ������Ϊ�˳�ȥ�����ֲ�Ӱ��Mn2+�����轫Fe2+������Al3+��ȫ����ʱ����ҪpHΪ5.2��Mn2+��ʼ������pHΪ8.1���������pHΪ5.2~8.1֮�䣬Ϊ�˲������µ����ʣ�ͬʱMnCO3������H+��Ӧ��ʹ���淴Ӧ��Fe3++3H2O![]() Fe(OH)3+3H+ƽ�������ƶ����ﵽ��ȥFe3+�����ã��ʴ�Ϊ��2Fe2++H2O2+2H+==2Fe3++2H2O��5.2��pH��8.1��B ����Һ����������ƽ�⣺Fe3+ + 3H2O
Fe(OH)3+3H+ƽ�������ƶ����ﵽ��ȥFe3+�����ã��ʴ�Ϊ��2Fe2++H2O2+2H+==2Fe3++2H2O��5.2��pH��8.1��B ����Һ����������ƽ�⣺Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+������MnCO3��H+��MnCO3��Ӧ��ʹ��Һ��c(H+)��С��ˮ��ƽ��������Fe(OH)3�ķ����ƶ����Ӷ�������������3���ӱ������ݿ�֪MnF2���ܶȻ�Զ����CaF2��MgF2�������MnF2�ܹ���Ca2+��Mg2+������ȫ���ʴ�Ϊ��MnF2����4���¶ȸ���27��ʱ��MnSO4���ܽ�����¶ȵ����߶����ͣ�Ϊ����ԭ�ϵ���ʧ����Ӧ���ȹ��ˣ��ʴ�Ϊ����ֹ�¶��½�ʱMnSO4��H2O�ܽ⣬���²��ʽ��ͣ���5��������������������Ӧ��Mn2+������ΪMnO2���ʴ�Ϊ��Mn2+ - 2e- +2H2O��MnO2 + 4H+��
Fe(OH)3 + 3H+������MnCO3��H+��MnCO3��Ӧ��ʹ��Һ��c(H+)��С��ˮ��ƽ��������Fe(OH)3�ķ����ƶ����Ӷ�������������3���ӱ������ݿ�֪MnF2���ܶȻ�Զ����CaF2��MgF2�������MnF2�ܹ���Ca2+��Mg2+������ȫ���ʴ�Ϊ��MnF2����4���¶ȸ���27��ʱ��MnSO4���ܽ�����¶ȵ����߶����ͣ�Ϊ����ԭ�ϵ���ʧ����Ӧ���ȹ��ˣ��ʴ�Ϊ����ֹ�¶��½�ʱMnSO4��H2O�ܽ⣬���²��ʽ��ͣ���5��������������������Ӧ��Mn2+������ΪMnO2���ʴ�Ϊ��Mn2+ - 2e- +2H2O��MnO2 + 4H+��

����Ŀ�����ݱ�����Ϣ���ж�������������ȷ����
��� | ������ | ��ԭ�� | ������Ӧ�� | �������� | ��ԭ���� |
�� | Cl2 | FeBr2 | / | Cl�� | |
�� | KClO3 | Ũ���� | / | Cl2 | |
�� | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A����������ķ�Ӧ������һ�ֻ�����Ԫ�ر�����
B��������ǿ���ıȽϣ� KClO3��Fe3+��Cl2��Br2
C���������鷴Ӧ�Ļ�ԭ������KCl������ת����Ŀ��6e��
D���������鷴Ӧ�����ӷ���ʽΪ��2MnO4��+ 3H2O2 + 6H+=2Mn2+ + 4O2��+ 6H2O
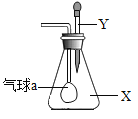
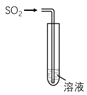
����Ŀ������ͼ��ʾ����SO2ͨ�����в�ͬ��Һ�У�ʵ�����������ý�������ȷ����
��Һ | ���� | ���� |
| |
A | Ʒ����Һ | ��ɫ��Һ��ɫ | SO2��Ư���� | |
B | H2S��Һ | ������ɫ���� | SO2�������� | |
C | ����KMnO4��Һ | ��ɫ��Һ��ɫ | SO2��Ư���� | |
D | ���з�̪��NaOH��Һ | ��ɫ��Һ��ɫ | SO2��ˮ��Һ������ |
A. A B. B C. C D. D