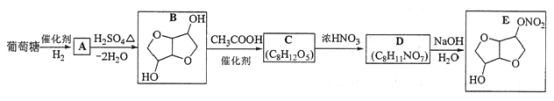
题目内容
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
【答案】B
【解析】试题分析:A、加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根和硝酸根离子,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,A错误;B、根据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,根据第二段是氢氧化钠与铵根反应得到一水合氨的阶段,即NH4++OH-=NH3H2O,消耗氢氧化钠的物质的量为0.7mol-0.5mol=0.2mol,所以溶液中n(NH4+)=0.2mol,B正确;C、据图象特点可以知道:加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,C错误;D、根据第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol,根据第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH-~[Al(OH)4]-,则消耗氢氧化钠的物质的量为:0.8mol-0.7mol=0.1mol,根据第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH-~Al(OH)3,Mg2+~2OH-~Mg(OH)2,0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol-0.1mol-0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+)︰n(Al3+)︰n(Mg2+)=0.1:0.1:0.05=2:2:1,D错误,答案选B。
【考点定位点评】本题是一道关于离子反应和离子检验知识的题目
【名师点晴】该题难度较大,侧重于考查学生分析和解决问题的能力,明确常见离子的性质和根据图像曲线判断出反应的化学方程式为解答的关键。关于图像的答题需要注意以下几点:①看面:弄清纵、横坐标的含义。②看线:弄清线的变化趋势,每条线都代表着一定的化学反应过程。③看点:弄清曲线上拐点的含义,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。曲线的拐点代表着一个反应过程的结束和开始。

 名校课堂系列答案
名校课堂系列答案【题目】软锰矿的主要成分为MnO2,还含有MgO、CaO、FeO、Fe2O3、Al2O3等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:

已知:① 几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
② 温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)已知:25℃、101kpa时,
Mn(s)+O2(g)=MnO2(s) △ H=-520 kJ/mol
S(s)+O2(g)=SO2(g) △ H=-297 kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(aq) △ H=-1065 kJ/mol
“浸出”过程中MnO2转化为MnSO4的热化学方程式为___________________________。
(2) “第1步除杂”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)____________________________________________,需要调节的pH的范围是_________________;所加的试剂X是_________ (填以下物质序号)。
A、MnO2 B、MnCO3 C、KMnO4 D、NaOH。
请用平衡移动原理分析,加入X能使除去浸出液中Fe3+的原因是:_______________。
(3)根据下表数据,选择“第2步除杂”所加的物质Y(由一种阳离子和一种阴离子组成),物质Y的化学式____________。
阴离子 Ksp 阳离子 | CO32- | F- | OH- |
Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
(4)采用“系列操作”中需要“趁热过滤”,其目的是_______________________________。
(5)以MnSO4溶液为原料,采用电解的方法可制备高纯度的MnO2,则电解池阳极的电极反应方程式为___________________________________________________________。