题目内容
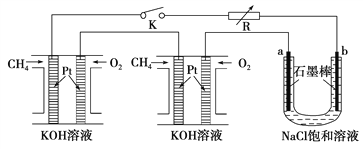
【题目】以下非金属性最强的元素为
A. 氟B. 氮C. 氧D. 碳
【答案】A
【解析】
同一周期的元素,原子序数越大,元素的非金属性越强。氟、氮、氧、碳都是第二周期的元素,原子序数F>O>N>C,所以元素的非金属性最强的是氟元素,故合理选项是A。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】软锰矿的主要成分为MnO2,还含有MgO、CaO、FeO、Fe2O3、Al2O3等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
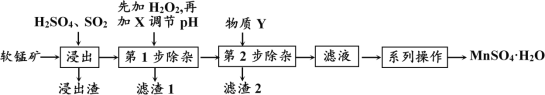
已知:① 几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
② 温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)已知:25℃、101kpa时,
Mn(s)+O2(g)=MnO2(s) △ H=-520 kJ/mol
S(s)+O2(g)=SO2(g) △ H=-297 kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(aq) △ H=-1065 kJ/mol
“浸出”过程中MnO2转化为MnSO4的热化学方程式为___________________________。
(2) “第1步除杂”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)____________________________________________,需要调节的pH的范围是_________________;所加的试剂X是_________ (填以下物质序号)。
A、MnO2 B、MnCO3 C、KMnO4 D、NaOH。
请用平衡移动原理分析,加入X能使除去浸出液中Fe3+的原因是:_______________。
(3)根据下表数据,选择“第2步除杂”所加的物质Y(由一种阳离子和一种阴离子组成),物质Y的化学式____________。
阴离子 Ksp 阳离子 | CO32- | F- | OH- |
Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
(4)采用“系列操作”中需要“趁热过滤”,其目的是_______________________________。
(5)以MnSO4溶液为原料,采用电解的方法可制备高纯度的MnO2,则电解池阳极的电极反应方程式为___________________________________________________________。