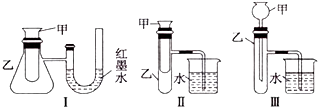
题目内容
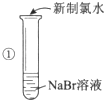
【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为黄色 | 氧化性:Cl2>Br2 |
| 溶液变为黄色 | 氧化性: |
| 溶液的颜色由黄色变为蓝色 |
反思与评价:
(1)步骤①反应的离子方程式为: .
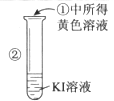
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
.
(3)你认为上述实验设计(填“能”或“不能”)达到实验目的,理由是 .
【答案】
(1)2Br﹣+Cl2=Br2+2Cl﹣
(2)向溶液中加入CCl4 , 振荡,静置,液体分为上下两层,下层呈紫红色
(3)不能;①中所得黄色溶液中可能含有Cl2 , 会干扰Br2、I2氧化性的比较
【解析】解:(1)步骤①溶液变为黄色是氯气与溴离子发生氧化还原反应,生成单质溴,反应的离子方程式为:2Br﹣+Cl2=Br2+2Cl﹣ , 所以答案是:2Br﹣+Cl2=Br2+2Cl﹣;(2)检验②中所得黄色溶液含I2的另一种方法是萃取的方法,具体操作向溶液中加入CCl4 , 振荡,静置,液体分为上下两层,下层呈紫红色,所以答案是:向溶液中加入CCl4 , 振荡,静置,液体分为上下两层,下层呈紫红色;(3)①中所得溶液中可能含有过量的氯气,对后继氧化性强弱的比较产生干扰,所以答案是:不能;①中所得黄色溶液中可能含有Cl2 , 会干扰Br2、I2氧化性的比较.
【考点精析】解答此题的关键在于理解氧化性、还原性强弱的比较的相关知识,掌握金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强.

【题目】某温度下,H2(g) + CO2(g) ![]() H2O(g)+ CO(g)的平衡常数K=9/4。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和 CO2(g),其起始浓度如下表所示
H2O(g)+ CO(g)的平衡常数K=9/4。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和 CO2(g),其起始浓度如下表所示
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/ mol·l-1 | 0.010 | 0.020 | 0.020 |
C(CO2)/ mol·l-1 | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A. 平衡时,乙中CO2 的转化率大于60%
B. 平衡时,甲和丙中H2 的转化率均是60%
C. 平衡时,丙中C(CO2)是甲中的2倍,是0.012 mol·l-1
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】实验室用密度为1.25gmL﹣1、质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为
(2)配制 240mL 0.1molL﹣1 的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 ) .
A.用30mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, .
②容量瓶中原有少量蒸馏水, .
③定容时观察液面俯视, .
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 .
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 .
③定容摇勻后发现液面下降