题目内容
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是

A. 图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示0.lmolMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C. 图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>l00
D. 图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
【答案】C
【解析】A.此图中反应物总能量与生成物的总能量差值出现变化,不可能是由于催化剂引起的,催化剂不能改变反应的热效应,故错误;B.氯化镁为强酸弱碱盐,在空气中加热发生水解生成氧化镁,0.1mol氧化镁的质量为4.0g,故错误;C.醋酸为弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中的氢离子浓度大于盐酸,所以pH变化小的为醋酸,且稀释到pH=4,b大于100,故正确;D.此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡正向移动,四氧化二氮的浓度变大,故错误。故选C。

练习册系列答案
相关题目
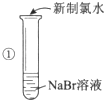
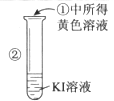
【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为黄色 | 氧化性:Cl2>Br2 |
| 溶液变为黄色 | 氧化性: |
| 溶液的颜色由黄色变为蓝色 |
反思与评价:
(1)步骤①反应的离子方程式为: .
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
.
(3)你认为上述实验设计(填“能”或“不能”)达到实验目的,理由是 .