题目内容
【题目】小明家中有如下生活用品:碘酒、食盐、食醋、84消毒液(有效成分为NaClO),小明利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉
B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢
D.洗去白色衣服上的番茄汁
【答案】B
【解析】
A.根据碘遇淀粉变蓝的性质,用碘酒检验淀粉,故A不选;
B.氯离子应该用硝酸银检验,但现在没有这种试剂,故不能检验,故B选;
C.水垢的成分是碳酸钙和氢氧化镁,能和醋酸反应,故C不选;
D.利用84消毒液的漂白性可洗去白色衣服上的番茄汁,故D不选。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】以反应5H2C2O4+2MnO4-+6H+===10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率υ(KMnO4)=2.5×10-4mol·L-1·s-1
C. 若生成a L CO2(标准状况),该反应转移的电子数为aNA/22.4
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
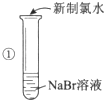
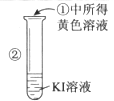
【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为黄色 | 氧化性:Cl2>Br2 |
| 溶液变为黄色 | 氧化性: |
| 溶液的颜色由黄色变为蓝色 |
反思与评价:
(1)步骤①反应的离子方程式为: .
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
.
(3)你认为上述实验设计(填“能”或“不能”)达到实验目的,理由是 .