��Ŀ����
����Ŀ��ʵ�������ܶ�Ϊ1.25gmL��1����������Ϊ36.5%��Ũ��������240mL 0.1molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ
��2������ 240mL 0.1molL��1 ������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
��3������ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�� �� ��
A����30mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12cm��
��4����ʵ�������������������������Һ�����ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ�����ƫ�͡����䡱����
������ϡ��������ձ�δϴ�ӣ� ��
������ƿ��ԭ����������ˮ�� ��
�۶���ʱ�۲�Һ�温�ӣ� ��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶� ��
��������ƿ��ת����Һʱ�й�Һ��������Һ���� ��
�۶���ҡ�����Һ���½�
���𰸡�
��1��12.5mol��l��1
��2��2.0��250
��3��B��C��A��F��E��D
��4��ƫ�ͣ����䣻ƫ��
��5������������������������
���������⣺��1��Ũ��������ʵ���Ũ��Ϊ ![]() =12.5mol/L��
=12.5mol/L��
���Դ��ǣ�12.5mol��l��1��
��2������240mL0.1molL��1�����ᣬӦѡ��250mL����ƿ��ʵ������250mL��Һ������ҪŨ�������ΪV����������Һϡ���� �����ʵ����ʵ�������ã�V��12.5mol/L=0.1mol/L��250mL�����V=2.0mL��
���Դ��ǣ�2.0��250��
��3������һ�����ʵ���Ũ�ȵ���Һ���裺���㡢�������ܽ⡢ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȣ�����ȷ��˳��Ϊ��BCAFED��
���Դ��ǣ�BCAFED��
��4��������ϡ��Ũ������ձ�δϴ�ӣ���������ƫ�٣�Ũ��ƫ�ͣ�
���Դ��ǣ�ƫ�ͣ�
������ƿ��ԭ����������ˮ������Һ��Ũ����Ӱ�죬��Һ��Ũ�Ȳ��䣻
���Դ��ǣ����䣻
�۶���ʱ�۲�Һ�温�ӣ�������Һ�����ƫС����Һ��Ũ��ƫ�ߣ�
���Դ��ǣ�ƫ�ߣ�
��5���ٶ���ʱ������ˮʱ�����˿̶ȣ���Һ��Ũ��ƫС����Ҫ�������ã����Դ��ǣ��������ã�
��������ƿ��ת����Һʱ�й�Һ��������Һ��������Һ��Ũ��ƫС����Ҫ�������ã����Դ��ǣ��������ã�
�۶���ҡ�����Һ���½�����Һ��Ũ�Ȳ��䣻���Դ��ǣ��������䣮
�����㾫����ͨ�������������һ�����ʵ���Ũ�ȵ���Һ�������������ʵ���Ũ����Һʱ�������ձ�������ˮ������ƿ�̶���1cm��2cm���ٸ��ý�Ͷ�ιܼ�ˮ���̶������Խ����⣮

����Ŀ��ijͬѧ�������̽��ʵ�飺
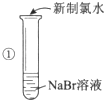
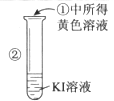
ʵ��Ŀ�ģ��Ƚ�Cl2��Br2��I2���ֵ��ʵ�������ǿ��
ʵ��ҩƷ��NaBr��Һ��KI��Һ����ˮ��������Һ
ʵ���¼��
ʵ�鲽�� | ʵ������ | ʵ����� |
| ��Һ��Ϊ��ɫ | �����ԣ�Cl2��Br2 |
| ��Һ��Ϊ��ɫ | �����ԣ� |
| ��Һ����ɫ�ɻ�ɫ��Ϊ��ɫ |
��˼�����ۣ�
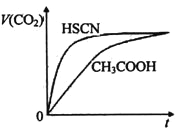
��1������ٷ�Ӧ�����ӷ���ʽΪ�� ��
��2������������û�ɫ��Һ��I2����һ�ַ����ǣ�����ʵ���������Ӧ��ʵ������
��
��3������Ϊ����ʵ����ƣ���ܡ����ܡ����ﵽʵ��Ŀ�ģ������� ��