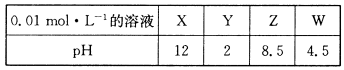
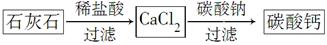题目内容
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
(1)Mg(OH)2(s)  Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解
Mg2+(aq)+2OH -(aq)(1分),盐酸中的H+与OH-中和使得OH-浓度减小平衡右移(1分),沉淀溶解
(2)NH4++H2O 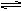 NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
(3)排除实验Ⅰ、Ⅱ中(1分)溶剂水使沉淀溶解的可能性(1分)(只答“4 mL水不能使沉淀溶解”给1分)
(4)溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解(2分)
(5)①沉淀溶解(1分) ②混合溶液显碱性,c(H+)非常小(1分,或答“H+不与OH-结合”), c(NH4+)较大(1分,或答“c(NH4+)与NH4Cl溶液接近”)能确定是NH4+结合OH-使沉淀溶解
解析试题分析:(1)Mg(OH)2存在沉淀溶解平衡:Mg(OH)2(s) 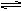 Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
(2)NH4Cl为强酸弱碱盐,NH4+发生水解反应,离子方程式为:NH4++H2O 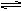 NH3·H2O+H+
NH3·H2O+H+
(3)实验Ⅰ、Ⅱ加入溶液,水增多,所以该实验的目的是:排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性。
(4)NH4+能与OH?结合,生成弱电解质NH3?H2O,所以溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解。
(5)①所加的混合液pH约为8,为碱性,所以沉淀溶解,可证明第二种猜测成立。
②混合液pH约为8,显碱性,c(H+)非常小,而NH4+少量溶解,c(NH4+)浓度较大,可确定沉淀溶解的原因是NH4+与OH?反应,促进沉淀溶解平衡向右移动。
考点:本题考查沉淀溶解平衡、盐类的水解、实验方案的分析。

(1)室温下在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol?L—1。
(2)浓度为0.1mol?L—1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3?H2O ④CH3COONH4
(3)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H+ +HA—,HAˉ H+ +A2—。
H+ +A2—。
①则Na2A溶液显____性;NaHA溶液显 性(填“酸性”、“中性”或“碱性”)。
②若有0.1mo1?L—1Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2—)>c(OH—)>c(HA—)>c(H+) |
| B.c(Na+)> c(OH—)>c(HA—)> >c(A2—) > c(H+) |
| C.c(Na+)> c(H+)> c(A2—)> c(OH—)>c(HA—) |
| D.c(A2—)>c(Na+)> c(OH—) > c(H+)>c(HA—) |
①当AgBr沉淀开始析出时,溶液中Ag+浓度是 。
②当AgC1沉淀开始析出时,溶液中的Br—、I—是否完全沉淀 (当溶液中离子浓度小于1.0×10—5mo1/L时,认为已经沉淀完全,本空选填“是”或“否”)。
已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示: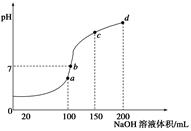
| | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ | 阴离子 | CO32-、Cl-、OH-、SO42- |
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中
 = ;
= ;(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。