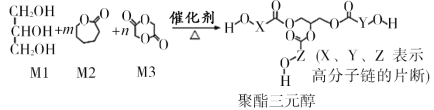
题目内容
【题目】下表是五种主族元素的结构特点及其元素、单质、化合物的性质.
元素 | 结构特点及元素、单质、化合物的性质 |
X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
W | 最外层电子排布(n+1)sn(n+1)pn﹣1 |
T | 单质升华可以产生紫色的烟 |
(1)写出X元素的原子核外电子排布__;其单质的化学性质__(填“稳定”或“活泼”),该元素的非金属性__(填“强”或“弱”),证明其强弱的理由是__.
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式__;已知w的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为__.
(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:__,__.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为__.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
【答案】1s22s22p3 稳定 强 硝酸是强酸 ![]() 分子晶体 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH﹣=AlO2﹣+2H2O AB
分子晶体 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH﹣=AlO2﹣+2H2O AB
【解析】
五种主族元素中,X气态氢化物与最高价氧化物对应水化物可以化合成盐,则X为N元素;Y原子中s电子数与p电子数相同,且p电子的能量最高,核外电子排布为1s22s22p4,则Y为O元素;Z单质在空气中燃烧产生黄色火焰,生成黄色粉末,则Z为Na;W元素原子最外层电子排布(n+1)sn(n+1)pn﹣1,由于s能级只能容纳2个电子,且p能级已填充电子,故n=2,则W为Al;T单质升华可以产生紫色的烟,则T为I元素,据此解答。
(1)X为N元素,电子排布式为1s22s22p3;其单质中存在氮氮三键,化学性质稳定,该元素的非金属性强,证明其强弱的理由是:硝酸是强酸等,故答案为:1s22s22p3;稳定;强;硝酸是强酸;
(2)Z单质在空气中燃烧生成黄色粉末为Na2O2,其电子式为![]() ;已知W的氯化物在177.8°C时会发生升华现象,熔沸点很低,由此可以判断它的晶体类型为:分子晶体,故答案为:
;已知W的氯化物在177.8°C时会发生升华现象,熔沸点很低,由此可以判断它的晶体类型为:分子晶体,故答案为:![]() ;分子晶体;
;分子晶体;
(3)W的最高价氧化物对应的水化物为氢氧化铝,X、Z的最高价氧化物对应的水化物分别为硝酸、NaOH,氢氧化铝与硝酸、氢氧化钠反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH﹣=AlO2﹣+2H2O;故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH﹣=AlO2﹣+2H2O;
(4)O、I可形成多种化合物,其中I元素的化合价为+3、+5时,可以看作I2O3、I2O5 混合物,二者1:1混合时为I2O4,二者1:3混合时为I4O9,由O、I原子数目之比可知不可能为I6O10,由于I元素化合价可知,不能为I2O3,故选:AB。

【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。