题目内容
【题目】某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
(提出猜想)小组提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2
丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)查阅资料得知,NO2可被NaOH溶液吸收,反应的化学方程式为:____________.
(2)实验前,小组成员经讨论认定猜想丁不成立,理由是____________.
(实验操作)
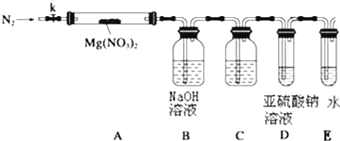
(3)设计如图装置,用氮气排尽装置中空气,其目的是___________;加热Mg(NO3)2固体,AB装置实验现象是:____________,说明有Mg(NO3)2固体分解了,有NO2生成.
(4)有同学提出可用亚硫酸钠溶液检验是否有氧气产生,但通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,其作用是:____________
(5)小组讨论后认为即便通过C后有氧气,仅仅用亚硫酸钠溶液仍然难以检验,因为:____________,改进的措施是可在亚硫酸钠溶液中加入____________.
(6)上述系列改进后,如果分解产物中有O2存在,排除装置与操作的原因,未检测到的原因是____________.(用化学方程式表示)
【答案】2NO2+2NaOH=NaNO3+NaNO2+H2O 不符合氧化还原反应原理 避免对产物O2的检验产生干扰(或其它合理答案 固体减少,产生红棕色气体,溶液中有气泡冒出 确保二氧化氮已被除尽,防止干扰氧气的检验 亚硫酸钠溶液与氧气反应没有明显现象,难以判断反应是否发生了 几滴酚酞试剂 4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O
【解析】
(1)NO2在碱性条件下自身发生氧化还原反应,与氢氧化钠反应生成NaNO3和NaNO2;
(2)根据氧化还原反应化合价升降相等判断;
(3)为检验是否生成氧气,应将装置内的氧气排尽;加热Mg(NO3)2固体,固体质量减小,如生成红棕色气体,则有NO2生成;
(4)亚硫酸钠具有还原性,可被氧气氧化,也可被二氧化氮氧化;
(5)亚硫酸钠溶液与氧气反应没有明显现象,结合亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性判断;
(6)如果分解产物中有O2存在,但没有检测到,可能原因是二氧化氮、氧气与水反应。
(1)NO2在碱性条件下自身发生氧化还原反应,与氢氧化钠反应生成NaNO3和NaNO2,反应的方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O;
(2)由于丁产物中化合价只有降低情况,没有升高,不满足氧化还原反应的特征,不符合氧化还原反应原理;
(3)为检验是否生成氧气,应将装置内的氧气排尽,避免对产物O2的检验产生干扰,加热Mg(NO3)2固体,固体质量减小,如生成红棕色气体,则有NO2生成;
(4)亚硫酸钠具有还原性,可被氧气氧化,也可被二氧化氮氧化,通入之前,还需在BD装置间增加滴有酚酞的氢氧化钠溶液,可确保二氧化氮已被除尽,防止干扰氧气的检验;
(5)亚硫酸钠溶液与氧气反应没有明显现象,结合亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性判断,可滴加几滴酚酞试剂,如溶液由红色变为无色,说明有氧气生成;
(6)如果分解产物中有O2存在,但没有检测到,可能原因是二氧化氮、氧气与水反应,发生方程式为4NO2+O2+2H2O=4HNO3 或4NO2+O2+4NaOH=4NaNO3+2H2O。

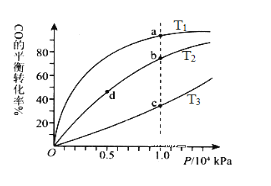
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
【题目】下表是五种主族元素的结构特点及其元素、单质、化合物的性质.
元素 | 结构特点及元素、单质、化合物的性质 |
X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
W | 最外层电子排布(n+1)sn(n+1)pn﹣1 |
T | 单质升华可以产生紫色的烟 |
(1)写出X元素的原子核外电子排布__;其单质的化学性质__(填“稳定”或“活泼”),该元素的非金属性__(填“强”或“弱”),证明其强弱的理由是__.
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式__;已知w的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为__.
(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:__,__.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为__.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.