题目内容
往AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤液中滴加盐酸有白色沉淀生成,则析出的少量金属一定是
| A.Ag | B.Cu | C.Fe | D.Zn |
A
解析试题分析:过滤后往滤液中滴加盐酸有白色沉淀生成,这说明硝酸银过量。锌的金属性强于铁,硝酸锌与铁不反应。由于氧化性是Ag+>Cu2+,所以铁首先与硝酸银反应生成硝酸亚铁与单质银,因此析出的少量金属一定是Ag,答案选A。
考点:考查氧化还原反应的有关判断

新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO,下列就该反应的分析错误的是
Si3N4+6CO,下列就该反应的分析错误的是
| A.压强增大,平衡向逆反应方向移动 |
| B.SiO2是氧化剂,CO是氧化产物 |
| C.上述反应若为放热反应,升高温度,平衡常数将减小 |
| D.上述反应中每生成1 molSi3N4,氮元素得12mol电子 |
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol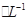 |
C.反应后溶液中c(NO3-)=1.6mol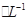 |
| D.反应后的溶液最多还能溶解1.6lgFe |
将KClO3、I2各0.02 mol加入12 g 36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),将过滤后的溶液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是
| A.IClO | B.ICl3 | C.I2Cl6 | D.KIO3 |
以下说法错误的是
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
下列变化中,需加氧化剂才能实现的是
| A.NaClO →NaCl | B.Na2O2 → O2 | C.C → CO2 | D.CaO→Ca(OH)2 |
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为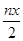 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+5H2O2+6H+=2Mn2++5O2↑+8H2O