题目内容
以下说法错误的是
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
C
解析试题分析:A、物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫还原反应,正确;B、部分金属阳离子,如Fe2+,在氧化还原反应中也可作还原剂,错误;C、含非金属元素的离子,如ClO?,在氧化还原反应中也可作氧化剂,错误;D、非金属原子越容易得到电子,说明金属性越强,则单质氧化性越强,正确。
考点:本题考查氧化还原反应及规律。

练习册系列答案
相关题目
下列反应既属于氧化还原反应,又是吸热反应的是
| A.灼热的碳与CO2的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.铝片与稀盐酸的反应 | D.甲烷在氧气中的燃烧反应 |
将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
往AgNO3、Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤液中滴加盐酸有白色沉淀生成,则析出的少量金属一定是
| A.Ag | B.Cu | C.Fe | D.Zn |
下列叙述中正确的是
| A.氧化还原反应的实质是元素化合价的升降 |
| B.非金属元素从化合态变为游离态时,该元素一定被氧化 |
| C.氧化剂氧化其他物质时本身一定被还原 |
| D.具有氧化性的物质在反应中一定做氧化剂 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是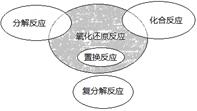
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
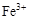 和
和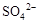 ,同
,同