题目内容
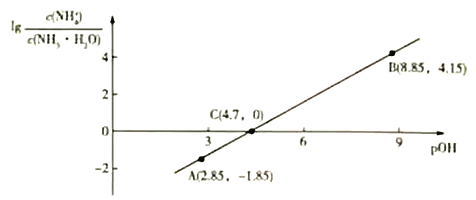
【题目】25℃时,将0.1mo/L的NaOH溶液滴入盛有50mLpH=2的HA溶液的绝热容器中(忽略热胀冷缩和分子空隙对体积的影响),加入NaOH溶液的体积V与溶液温度T的关系如图,下列说法不正确的是( )

A.25℃时,该pH=2的HA溶液电离度为10%
B.b点溶液显碱性
C.b到c的过程中,温度下降的主要原因是NaOH溶液的加入
D.c点溶液中,c(Na+)<c(A-)+c(OH-)
【答案】A
【解析】
由图可知,随NaOH溶液的加入,酸碱中和放热使溶液温度升高,当加入的NaOH溶液的体积为40mL时,温度达到最高,说明此时反应恰好完全,则原HA溶液的浓度为:c(HA)= ![]() =0.08mol/L;继续加入NaOH溶液,溶液温度逐渐下降。可在此认识基础上对各选项作出判断。
=0.08mol/L;继续加入NaOH溶液,溶液温度逐渐下降。可在此认识基础上对各选项作出判断。
A.根据分析,原HA溶液的浓度为0.08mol/L,所以,25℃时,该pH=2的HA溶液电离度为![]() ×100%=12.5%,A选项错误;
×100%=12.5%,A选项错误;
B.根据分析,b点溶液为NaA溶液。根据A选项可知HA为弱酸,所以NaA溶液显碱性,B选项正确;
C.b点HA恰好完全反应,所以b到c的过程中,无反应发生,NaOH溶液的加入使溶液温度下降,C选项正确;
D.根据电中性原则,c点溶液中有:c(Na+)+c(H+)=c(A-)+c(OH-),所以,c(Na+)<c(A-)+c(OH-),D选项正确;
答案选A。

 发散思维新课堂系列答案
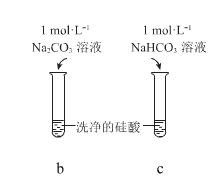
发散思维新课堂系列答案【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用 Na2SiO3 溶液制备硅酸。某小组同学进行了如下实验:
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
下列结论不正确的是
A.Na2SiO3 溶液一定显碱性
B.由 Ⅰ 不 能 说 明 酸 性 H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时 Na2CO3 溶液的碱性强于 NaHCO3 溶液
D.向 Na2SiO3 溶液中通入过量 CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓