题目内容
100ml 2mol/LNaOH溶液中通入一定量的CO2,反应后溶液中Na2CO3和NaHCO3的物质的量浓度之比为1∶2。则:
(1)写出其中生成Na2CO3的反应的离子方程式: 。
(2)生成碳酸氢钠的物质的量为 mol。
(3)若往原NaOH溶液中通入标准状况下的CO2气体1.12L后,再逐滴滴加0.5mol/L的盐酸,至少加入 ml后才会有CO2气体放出(不考虑CO2溶解在水中)。
(1)CO2+ 2OH- = CO32-+ H2O
(2)0.1 (3)300
解析试题分析:(1)CO2+ 2OH- = CO32-+ H2O
(2)100ml 2mol/LNaOH ,n(NaOH)="0.2" mol ,由钠离子守恒知:2n(Na2CO)3+n(NaHCO3) =0.2且Na2CO3和NaHCO3的物质的量之比为1∶2,所以n(NaHCO3)="0.1" mol 。
(3)原NaOH溶液中n(NaOH)="0.2" mol,通入CO2气体0.05mol假如生成0.05mol NaHCO3,剩余0.15molNaOH ,需要通入0.15molHCl,即加入300ml0.5mol/L的盐酸。
考点:NaOH溶液和CO2的反应

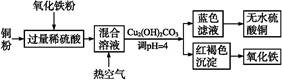
某课外小组对一些金属单质和化合物的性质进行探究。
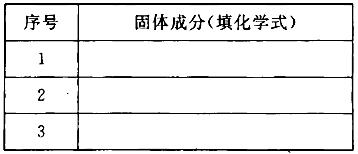
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应______________________________________________________;
化合反应______________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是________________________。
解释此现象的离子方程式是______________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_____________________________________。
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |