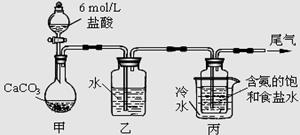
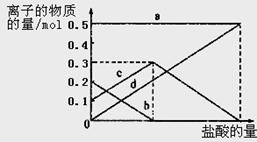
题目内容
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(1)K2FeO4 4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-
(2)+6价的铁具有强氧化性可以杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体净水
(3)3KClO+4KOH+2Fe(OH)3=2K2FeO4+3KCl+5H2O (4)B;
(5)取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢
解析试题分析:(1)根据题意可知:该化合物与水发生反应产生的红褐色的沉淀为Fe(OH)3,气体为O2,红棕色粉末是 Fe2O3n(Fe2O3)="m/M=" 1.60g÷160g=" 0.01mol" , n(Fe) ="0.02mol.," 滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐是K2SO4,质量为10.44g。n(K2SO4)=1044g÷174g/mol=0.06mol,所以原固体中含有的K+的物质的量为0.06×2-0.08=0.04mol,m(O)=" 3.96g" -0.02mol×56g/mol- 0.04mol× 39g/mol= 1.28g,所以n(O)=1.28g÷16g/mol=0.08mol.因此在化合物A中个元素的个数比为K:Fe:O=0.04:0.02:0.08=2:1:4.故化学式为K2FeO4。它与水反应的化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+3O2↑+8KOH。 离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-。(2)K2FeO4还可作为一种“绿色高效多功能”水处理剂。原因是FeO42-中的Fe元素的化合价为+6价,有强的氧化性,可以起到杀菌消毒的作用,其还原产物为Fe3+,水解产生氢氧化铁胶体表面积大,吸附力强,能够吸附水中的固体颗粒使之转化为沉淀而达到净化水的作用。(3)在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式3KClO+4KOH+ 2Fe(OH)3= 2K2FeO4+3KCl+5H2O。(4)因为在水溶液在发生离子反应 4FeO42-+10H2O =4Fe(OH)3↓+3O2↑+8OH-,所以要提高其稳定性,应该使溶液显碱性。亚硫酸钠 、KOH呈碱性,但考虑到亚硫酸钠有还原性,K2FeO4有强氧化性,二者会发生氧化还原反应而不能共存,因此有可能提高化合物A水溶液稳定性的物质只能是KOH。(5)为研究温度对化合物A水溶液稳定性的影响实验方案是取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢。
考点:考查K2FeO4的组成、结构、性质及用途的知识。

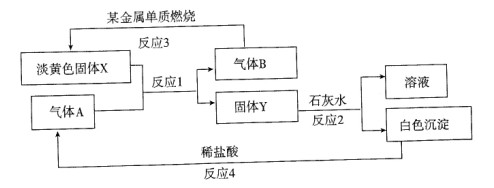
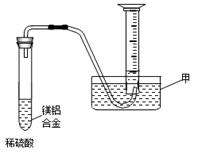
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:
(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用 。
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
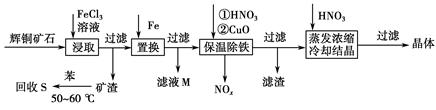

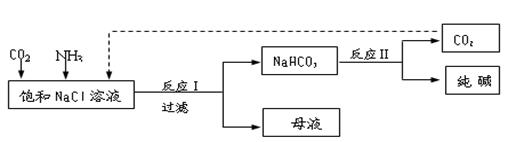
 NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法: