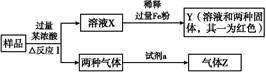
题目内容
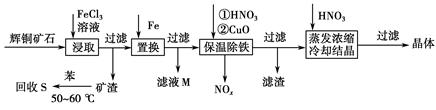
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是__________________,分离得到固体的主要成分是________,从固体中分离出铜需采用的方法是___________________________________;
(3)过程Ⅱ中发生反应的化学方程式为________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为__________________________。(列式计算)
(1)2Fe3++Cu=2Fe2++Cu2+
(2)回收铜 铜和铁 加盐酸后过滤
(3)FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)c(Fe3+)=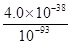 =4.0×10-11 mol/L
=4.0×10-11 mol/L
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

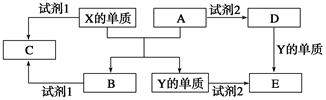

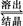 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]