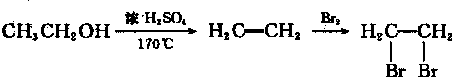题目内容
常温下,下列溶液中离子浓度关系表达正确的是( )
| A、Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B、0.1mol?L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、向NH4HSO4的水溶液中逐滴滴入NaOH溶液,至中性的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) |
| D、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小;
C.如果二者以1:1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量;
D.pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,二者等体积混合,醋酸有剩余,溶液呈酸性.
B.氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小;
C.如果二者以1:1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量;
D.pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,二者等体积混合,醋酸有剩余,溶液呈酸性.
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故A错误;
B.氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小,所以存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.如果二者以1:1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量,铵根离子水解,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故C正确;
D.pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,二者等体积混合,醋酸有剩余,溶液呈酸性,则c(OH-)<c(H+),故D错误;
故选C.
B.氯化铵是强酸弱碱盐,溶液呈酸性,铵根离子能水解,但程度较小,所以存在c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.如果二者以1:1反应,溶液中的溶质是硫酸钠、硫酸铵,溶液呈酸性,要使溶液呈中性,则氢氧化钠稍微过量,铵根离子水解,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),故C正确;
D.pH=3的醋酸溶液浓度大于pH=11的氢氧化钠溶液浓度,二者等体积混合,醋酸有剩余,溶液呈酸性,则c(OH-)<c(H+),故D错误;
故选C.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液酸碱性再结合守恒思想分析解答,注意C中采用逆向思维方法分析,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
下列离子方程式正确的是( )
| A、在硫酸亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、MnO2与浓盐酸反应制取Cl2:MnO2+4HCl(浓)
| ||||
| C、过量的KHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||
| D、向稀氢氧化钠溶液中通入少量CO2:OH-+CO2═HCO3- |
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
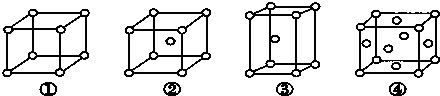

| A、①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积 |
| B、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| C、金属镁采取③的堆积方式 |
| D、空间利用率的大小关系为:①<②<③<④ |
化学与生产、生活和社会密切相关,下列说法正确的是( )
| A、汽车排放的尾气和燃煤排放颗粒污染物是形成雾霾的重要因素 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、“低碳”生活倡导节能减排,禁止使用化石燃料,减少污水排放 |
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ |
| B、Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ |
| C、CaC2+2H2O═Ca(OH)2+CH≡CH↑ |
| D、NH4Cl+NaOH═NaCl+NH3↑+H2O |



 (R为烃基)
(R为烃基) 反应合成聚碳酯的化学方程式
反应合成聚碳酯的化学方程式