题目内容
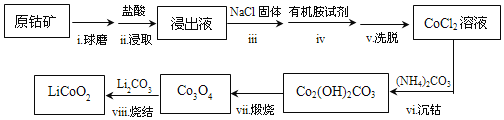
【题目】LiCoO2是锂离子电池常用的电极材料。利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如图:
资料:①在含一定量Cl-的溶液中,钻离子以CoCl![]() 形式存在:Co2++4Cl-
形式存在:Co2++4Cl-![]() CoCl
CoCl![]()
②CoCl![]() 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
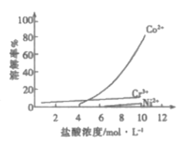
(1)步骤ⅱ选用盐酸的浓度应为___,该过程要注意在通风橱中进行的原因为___(用离子方程式表示)。
a.4mol/L b.6mol/L c.10mol/L
(2)从平街移动角度解释步骤中加入NaCl固体的目的___。
(3)步骤ⅳ的操作是___。
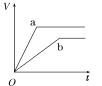
(4)步骤ⅵ用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钻Co2(OH)2CO3]。已知碱式碳酸钻在339℃以上开始分解,实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示。分析曲线下降的原因___。
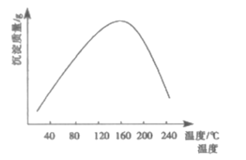
(5)步骤ⅷ中Co3O4和Li2CO3混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是___。
(6)多次实验测定该原钴矿中钴元素的质量分数为1.18%,则原钴矿中Co2O3的质量分数为___%。(假设原钻矿中含钻元素的物质只有Co2O3)。
【答案】c NiS+2H+=Ni2++H2S↑ 加入NaCl固体,溶液中Cl-浓度增大,平衡Co2++4Cl-![]() CoCl
CoCl![]() 右移,CoCl
右移,CoCl![]() 浓度增大,提高其在有机胺试剂中的浓度 分液 温度过高,碳酸铵分解(或NH
浓度增大,提高其在有机胺试剂中的浓度 分液 温度过高,碳酸铵分解(或NH![]() 和CO
和CO![]() 水解程度增大),碳酸铵浓度降低,沉淀质量减少 4Co2O3+6LiCO3+O2
水解程度增大),碳酸铵浓度降低,沉淀质量减少 4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2 1.66
12LiCoO2+6CO2 1.66
【解析】
原钴矿(含Cr2O3、NiS等杂质),球磨后加入盐酸浸取,由题给信息可知,为分离Co与Cr、Ni,加入盐酸浓度在10mol/L以上,浸出液加入氯化钠固体,CoCl42-浓度增大,提高其在有机胺试剂中的浓度,加入有机胺试剂萃取,洗脱,可得到CoCl2溶液,加入碳酸铵生成碱式碳酸钴,煅烧生成Co3O4,加入碳酸锂,可生成目标物,以此解答该题。
(1)步骤ii选用盐酸的浓度应为10mol/,可用于分离Co与Cr、Ni;由于原料中含有NiS与盐酸反应生成H2S,H2S有毒,故应在通风橱中进行,反应的离子方程式为:NiS+2H+=Ni2++H2S↑,故答案为:c;NiS+2H+=Ni2++H2S↑;
(2)步骤ⅲ中加入NaCl固体,可使溶液中Cl-浓度增大,平衡Co2++4Cl-CoCl42-右移,CoCl42-浓度增大,提高其在有机胺试剂中的浓度,故答案为:加入NaCl固体,溶液中Cl-浓度增大,平衡Co2++4Cl-![]() CoCl
CoCl![]() 右移,CoCl
右移,CoCl![]() 浓度增大,提高其在有机胺试剂中的浓度;
浓度增大,提高其在有机胺试剂中的浓度;
(3)步骤iv加入有机溶剂,用于萃取,可用分液的方法分离,故答案为:分液;
(4)由图象可知,温度升高,沉淀曲线下降,原因为温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少。(或温度过高Co2(OH)2CO3分解,沉淀质量减少。),故答案为:温度过高,碳酸铵分解(或NH![]() 和CO
和CO![]() 水解程度增大),碳酸铵浓度降低.沉淀质量减少;
水解程度增大),碳酸铵浓度降低.沉淀质量减少;
(5)Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2,方程式为4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2,故答案为:4Co2O3+6LiCO3+O2
12LiCoO2+6CO2,故答案为:4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2;
12LiCoO2+6CO2;
(6)原钴矿中钴元素的质量分数为1.18%,则原钴矿中Co2O3的质量分数为1.18%![]() =1.66%,故答案为:1.66%。
=1.66%,故答案为:1.66%。