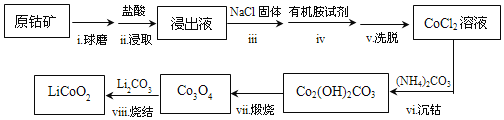
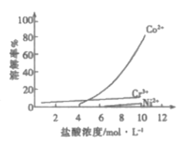
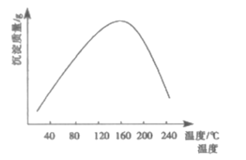
题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
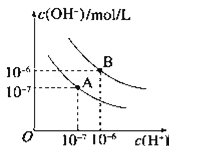
(1)95℃时水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的PH=_____.
(3)95℃时水的电离平衡曲线应为___(填“A”或“B”),请说明理由______________________.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________________.
【答案】1.0×10﹣12 10 B 水的电离是吸热过程,温度升高电离程度增大,c(H+)、c(OH﹣)均增大 10:1 pH1+pH2=14(或a+b=14)
【解析】
(1),常温下,水的离子积常数为KW=1014,曲线A条件下Kw=c(H+)×c(OH)=107×107=1014,曲线B条件c(H+)=c(OH)=106mol/L,Kw=c(H+)c(OH)=1012,故曲线B表示95℃时的水的离子积常数;
故答案为:1.0×1012;
(2)95℃时,0.01mol/LNaOH溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为:1010mol/L,所以溶液的PH=10,
故答案为:10;
(3)95℃时,水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为106mol/L,水的电离是吸热过程,温度升高电离程度增大,c(H+)、c(OH)均增大,水的电离平衡曲线应为B;
答案为:B;水的电离是吸热过程,温度升高电离程度增大,c(H+)、c(OH)均增大;
(4)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH)=n(H+),则V(NaOH)105molL1=V(H2SO4)104molL1,得V(NaOH):V(H2SO4)=10:1,
故答案为:10:1;
(5)要注意的是95℃时,水的离子积为1012,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH浓度是强酸H+浓度的100倍,所以pH(酸)+pH(碱)=14,即pH1+pH2=14,或a+b=14,
故答案为:pH1+pH2=14(或a+b=14)。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式____________________________________。
(2)己知反应N2+3H2![]() 2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
化学键 | H-H | N-H | N≡N |
键能kJ/mol | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
己知:C(s,石墨)+O2(g)=CO2(g) △Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) △H3=-2599kJ/mol
裉推盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:__________。