题目内容
【题目】氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:
(1)瑞德西韦是一种抗病毒药物,结构如下。
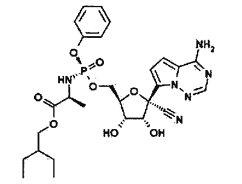
该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。
(2)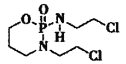 (异环磷酰胺)常用作抗癌药,1mol该物质含
(异环磷酰胺)常用作抗癌药,1mol该物质含![]() 键数目为______NA。
键数目为______NA。
(3)实验测得![]() 中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
(4)![]() 可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,
可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,![]() 的空间构型为____________。
的空间构型为____________。
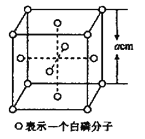
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为![]() ,晶体中白磷分子之间的最短距离为____________cm(用含
,晶体中白磷分子之间的最短距离为____________cm(用含![]() 、NA的式子表示)。
、NA的式子表示)。
【答案】O>N>P 氢键、范德华力 29 S ![]()
![]() 正四面体 16
正四面体 16 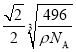
【解析】
根据白磷分子在晶胞中的位置,在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为![]() ,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16,然后计算1mol白磷分子晶胞的质量为
,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16,然后计算1mol白磷分子晶胞的质量为![]() ,计算出晶胞参数a。
,计算出晶胞参数a。
(1)同周期主族元素的电负性,从左到右随着元素原子序数的递增,电负性逐渐增强,故N、O、P原子的电负性由大到小的顺序为O>N>P;该药物的分子内含有氨基和羟基,所以该药物的分子间作用力有氢键、范德华力;
(2)1个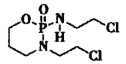 分子中含有29个
分子中含有29个![]() 键,故1mol该物质含
键,故1mol该物质含![]() 键数目为29NA;
键数目为29NA;
(3)SCN-的结构式为![]() ,因为Mn,C,N三种原子不在同一水平线上,所以S原子为配位原子提供孤电子对,形成配位键后,S原子的价层电子对数为4,并且S原子含有2对孤电子对,所以S原子的杂化方式为sp3;
,因为Mn,C,N三种原子不在同一水平线上,所以S原子为配位原子提供孤电子对,形成配位键后,S原子的价层电子对数为4,并且S原子含有2对孤电子对,所以S原子的杂化方式为sp3;
(4)As元素原子序数为33,为第ⅤA族元素,基态原子核外电子排布式为[Ar]3d104s24sp3,故As元素基态原子的价电子排布式为4s24sp3;![]() 的价层电子对数为4,并且中心原子As不含有孤电子对,故
的价层电子对数为4,并且中心原子As不含有孤电子对,故![]() 的空间构型为正四面体;
的空间构型为正四面体;
(5)在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为![]() ,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16;已知晶胞参数为acm,阿伏加德罗常数的值为NA,1mol该晶胞的质量为
,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16;已知晶胞参数为acm,阿伏加德罗常数的值为NA,1mol该晶胞的质量为![]() ,a=
,a= 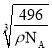 ,晶体中白磷分子的最短距离为该晶胞面对角线的一半,该晶胞的面对角线为
,晶体中白磷分子的最短距离为该晶胞面对角线的一半,该晶胞的面对角线为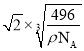 cm,故晶体中白磷分子之间的最短距离为
cm,故晶体中白磷分子之间的最短距离为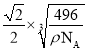 cm。
cm。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
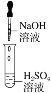
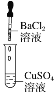
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑