题目内容
【题目】“低碳经济”正成为科学家研究的主要课题。将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
(1) 已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下图:
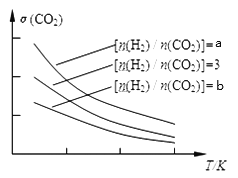
①a、3、b的大小关系___________
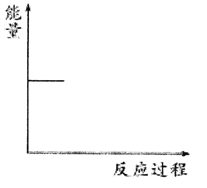
②请根据下图中信息在下图(右)中画出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的能量关系曲线___________。
(2)某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,上述反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的______
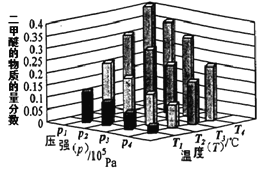
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)在恒容密闭容器里按体积比为1:3充入CO2(g)和H2(g),一定条件下上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的浓度增大
(4)下列一定能说明上述反应达到平衡的是___________
A.气体的平均摩尔质量不变
B.恒容条件下,气体的密度不变
C.各物质的速率之比等于系数比
D.[n(H2)/n(CO2)]不变
【答案】 a>3>b 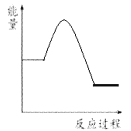 BD B A
BD B A
【解析】(1)①增大氢气的浓度提高CO2的转化率,则根据图像可知a、3、b的大小关系为a>3>b;②升高温度CO2的转化率降低,这说明平衡向逆反应方向进行,则正反应是放热反应,所以图像科表示为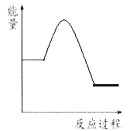 。(2)对于反应2CO2(g) + 6H2(g)
。(2)对于反应2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g),△H<0,压强越大,二甲醚的物质的量分数则越大,温度越高,二甲醚的物质的量分数越小,所以P1>P3、T1>T3,P1>P4、T2>T3,答案选BD。(3)A.正反应速率先增大后减小平衡向正反应方向进行,A错误;B.逆反应速率先增大后减小平衡一定向逆反应方向进行,B正确;C.化学平衡常数K值增大说明平衡向正反应方向进行,C错误;D.反应物的浓度增大不能判断平衡的移动方向,D错误,答案选B;(4)A.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以气体的平均摩尔质量不变说明反应达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以恒容条件下,气体的密度不变不能说明,B错误;C.任何时刻各物质的速率之比等于系数比,不能说明反应达到平衡状态,C错误;D.如果氢气和CO2是按照化学计量数之比充入反应,则任何时刻[n(H2)/n(CO2)]不变,不能说明反应达到平衡状态,D错误,答案选A。
CH3OCH3(g) + 3H2O(g),△H<0,压强越大,二甲醚的物质的量分数则越大,温度越高,二甲醚的物质的量分数越小,所以P1>P3、T1>T3,P1>P4、T2>T3,答案选BD。(3)A.正反应速率先增大后减小平衡向正反应方向进行,A错误;B.逆反应速率先增大后减小平衡一定向逆反应方向进行,B正确;C.化学平衡常数K值增大说明平衡向正反应方向进行,C错误;D.反应物的浓度增大不能判断平衡的移动方向,D错误,答案选B;(4)A.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以气体的平均摩尔质量不变说明反应达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以恒容条件下,气体的密度不变不能说明,B错误;C.任何时刻各物质的速率之比等于系数比,不能说明反应达到平衡状态,C错误;D.如果氢气和CO2是按照化学计量数之比充入反应,则任何时刻[n(H2)/n(CO2)]不变,不能说明反应达到平衡状态,D错误,答案选A。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
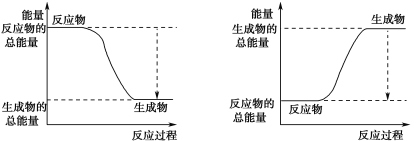
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止