题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25 mol/L。
(1)x的值是__________;
(2)B的平均反应速率__________;
(3)则反应开始前放入容器中A的物质的量_____________。
【答案】2 0.05mol/(L·min) 2mol
【解析】
(1)根据D的浓度求出V(D),然后根据物质反应时化学速率比等于计量数的比,可得x值;
(2)根据反应速率之比等于化学计量数之比求出V(B);
(3)根据反应速率计算出△n(A)结合5min时A的浓度就可计算出开始时A的浓度及物质的量。
(1) 5min后,测得D的浓度为0.5mol/L,则V(D)= 0.5mol/L÷5min=0.1mol/(L·min);
由于此时V(C)=0.1mol/(L·min)= V(D)。根据反应速率之比等于化学计量数之比,可知X=2;
(2) 根据反应速率之比等于化学计量数之比,V(B):V(D)=1:2,所以V(B)=![]() V(D)= 0.05mol/(L·min);
V(D)= 0.05mol/(L·min);
(3)根据反应速率之比等于化学计量数之比,V(A):V(B)=3:1,V(B)=0.05mol/(L·min),则V(A)=3V(B)=0.15mol/(L·min),A物质变化的物质的量为△n(A)= 0.15mol/(L·min)×5min×2L=1.5mol,此时反应混合物中A的物质的量浓度为0.25 mol/L,未反应的A的物质的量为0.25mol/L×2L=0.5mol,因此反应开始时A物质的物质的量为n(A)=0.5mol+1.5mol=2mol。

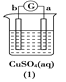
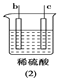
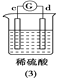
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
|
|
|
a极质量减小,b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. b>c>d>aC. a>b>c>dD. a>b>d>c
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
0~3 s内,反应速率v(O3)=0.2 mol·L-1·s-1 | 降低温度,平衡常数增大 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D