题目内容
【题目】4.35g二氧化锰与浓盐酸(密度为1.19gcm﹣3、质量分数为36.5%)完全反应.求:
(1)浓盐酸的物质的量浓度为多少?_______
(2)将所得气体全部用石灰乳吸收,可得到漂白粉的质量.________
【答案】11.9mol/L 6.35g
【解析】
(1)根据c=![]() 计算盐酸的物质的量浓度;
计算盐酸的物质的量浓度;
(2)漂白粉的成分是氯化钙、次氯酸钙,利用生成氯气的物质的量,根据方程式计算生成的氯化钙、次氯酸钙的物质的量。
(1)密度为1.19gcm﹣3、质量分数为36.5%浓盐酸的物质的量浓度为![]() mol/L=11.9mol/L;
mol/L=11.9mol/L;
(2)4.35g二氧化锰的物质的量为0.05mol,则:
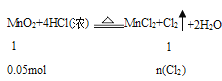
故n(Cl2)=0.05mol,用石灰乳吸收,则:
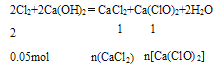
所以n(CaCl2)=n[Ca(ClO)2]=0.05mol×![]() =0.025mol,故可得漂白粉的质量为:0.025mol×111g/mol+0.025mol×143g/mol=6.35g。
=0.025mol,故可得漂白粉的质量为:0.025mol×111g/mol+0.025mol×143g/mol=6.35g。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21.则下列说法不正确的是
X | Y | ||
W | Z |
A.原子半径大小:![]()
B.W、Z的最高价氧化物的水化物的酸性,Z强于W
C.可用W与X的氧化物反应来制备X
D.Y与氢元素可以形成原子个数比为1:1的化合物