��Ŀ����
����Ŀ��ijѧ���������ʵ��װ�������Ʊ�������Cl2��
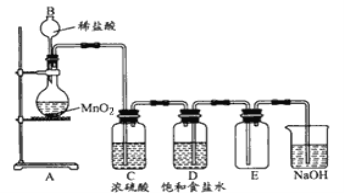
(1)װ�������崦������ָ��
��_______________
��_______________
��____________________
��_______________________
��_______________________
(2)�ڸ������װ��ͼ�У�ϴ��ƿ���������壩�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��ǣ� �ٱ���ʳ��ˮ�����ã�__________��Ũ��������ã�_________�����������Ƶ����ã�_____________
(3)��8.7gMnO2�뺬14.6gHCl��Ũ���Ṳ����Cl2,��ͬѧ��Ϊ���Ƶ�7.1gCl2,��ͬѧ��Ϊ�Ƶ�Cl2������С��7.1g������Ϊ_____ ��������������������ͬѧ��ȷ��������________
���𰸡�����̨���پƾ��� Ӧ��Ũ���� D��Ӧ��Ϊ�����ܽ����̵��ܳ� ����©������ӦΪ��Һ©�� CDװ������˳���� ��ȥ�����е��Ȼ������� ��ȥ�����е�ˮ���� ���ն������������ֹ��Ⱦ���� �� �������̺�HCl�����ʵ���֮��Ϊ1:4���ӷ�Ӧ����ʽ������ǡ����ȫ��Ӧ�������ŷ�Ӧ�Ľ��У�Ũ���ᷴӦһ��ʱ���Ϊϡ���ᣬ�Ͷ������̲���Ӧ
��������
(1)ʵ������Ũ��������������ڼ��������·�����Ӧ�Ʊ�������Ũ�����ӷ����Ʊ��������к����Ȼ��⡢ˮ�������ʣ�����ͨ������ʳ��ˮ��Ũ�����ϴ��ƿ�Ⱥ��ȥ�Ȼ����ˮ��ע��ϴ��ƿϴ��Ӧ�����̳��������ܶȴ���ˮ��Ӧ���������ſ������ռ���β������װ����ӦΪ����������
(2)�ڸ������װ��ͼ�У�ϴ��ƿ(��������)�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��dz�ȥ�����е��Ȼ��⡢ˮ����������ʣ�����������ã�
(3)���ŷ�Ӧ�Ľ��У�����Ũ�ȼ�С��ϡ������������̲���Ӧ��
(1)ʵ������Ũ��������������ڼ��������·�����Ӧ�Ʊ�������Ũ�����ӷ����Ʊ��������к����Ȼ��⡢ˮ������־������ͨ������ʳ��ˮ��Ũ�����ϴ��ƿ�Ⱥ��ȥ�Ȼ����ˮ��ע��ϴ��ƿϴ��Ӧ�����̳��������ܶȴ���ˮ��Ӧ���������ſ������ռ���β������װ����ӦΪ����������ͼ����������֮��Ϊ��������̨���پƾ��ƣ���Ӧ��Ũ��� ��D��Ӧ��Ϊ�����ܽ����̵��ܳ��� �ܳ���©������ӦΪ��Һ©���� ��CDװ������˳���ˣ�
(2)�ڸ������װ��ͼ�У�ϴ��ƿ(��������)�еı���ʳ��ˮ��Ũ���ᡢ����������Һ�����÷ֱ��ǣ��ٱ���ʳ��ˮ�����ã���ȥ�����е��Ȼ������壬��Ũ��������ã���ȥ�����е�ˮ���������������Ƶ����������ն������������ֹ��Ⱦ������
(3)���ŷ�Ӧ�Ľ��У�����Ũ�ȼ�С��ϡ������������̲���Ӧ�������ɵ���������С��7.1g����ͬѧ��˵����ȷ��