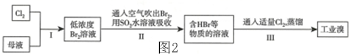
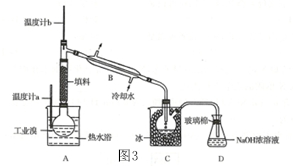
题目内容
1.0.1molO2中,含有0.2mol O;标准状况下,67.2L Cl2的物质的量为3mol;4gNaOH固体的物质的量为0.1mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为0.2mol/L.分析 根据n=$\frac{V}{Vm}$=$\frac{m}{M}$,c=$\frac{n}{V}$,结合分子的组成分析.
解答 解:0.1molO2中,含有0.2mol O;标准状况下,67.2L Cl2的物质的量为n=$\frac{V}{Vm}$=$\frac{67.2L}{22.4L/mol}$=3mol;
4gNaOH固体的物质的量为n=$\frac{m}{M}$=$\frac{4g}{40g/mol}$=0.1mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为c=$\frac{n}{V}$=$\frac{0.1mol}{0.5L}$=0.2mol/L;
故答案为:0.2;3;0.1;0.2mol/L.
点评 本题考查物质的量以及物质的量浓度的计算,题目难度不大,注意有关公式的运用,侧重于考查学生的计算能力.

练习册系列答案
相关题目
17.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe═Sb4O6+6FeS;②Sb4O6+6C═4Sb+6CO.下列说法正确的是( )
| A. | 反应②说明高温下Sb还原性比C强 | |
| B. | 反应①②中氧化剂分别是Sb2S3、Sb4O6 | |
| C. | 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为1:1 | |
| D. | 反应①中每生成1 mol FeS时,共转移2mol电子 |
16.下列有关化学用语中最能体现氮原子核外电子运动状态的是( )
| A. | 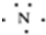 | B. |  | ||
| C. | 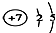 | D. | 1s22s22p3 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| B. | 1 mol•L-1 Na2CO3溶液中含有的钠离子数为2NA | |
| C. | 28 g N2中含有的原子数为NA | |
| D. | 1 mol Mg与足量稀盐酸反应,转移的电子数为2NA |