题目内容
9.综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图1所示:
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质得到精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过了的Na2CO3溶液;⑤过滤;⑥加适量的盐酸;⑦蒸发结晶.
(2)溶液Ⅱ中发生反应的化学方程式是NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用MgCl2溶液进行洗涤以除之.
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑.
(5)若在母液中通入氯气可提取海水中的溴,过程如图2:
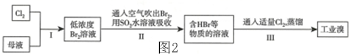
①反应 I的离子方程式:Cl2+2Br-═Br2+2Cl-.
②步骤 I中已获得Br2,步骤 II又将Br2还原为Br-,其目的为富集溴元素.
③步骤 II中,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
④某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料.Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性,他们参观生产过程后,了解到如图3所示的装置:
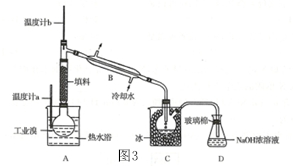
( I)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是Br2腐蚀橡胶.
( II)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?控制温度计b的温度,并收集59℃时的馏分.
( III)C中溶液产生颜色为深红棕色,为除去该物质中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是分液(或蒸馏 ).
分析 (1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;
(2)根据碳酸钠的生产进行分析,向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠;
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可根据沉淀可向溶解度更小的沉淀转化选择加入MgCl2;
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,还有氯化氢和水蒸气,据此书写方程式;
(5)①氯气具有氧化性,其氧化性强于溴单质,氯气能氧化溴离子;
②步骤I中获取的溴浓度较小,步骤 II又将Br2还原为Br-,其目的为富集溴元素;
③步骤 II中,生成硫酸和氢溴酸都是强酸,对设备腐蚀较严重;
④( I)溴单质是一种强氧化剂,易腐蚀橡胶制品;
( II)为制取较纯净的溴单质,应该控制b的温度;
( III)C溶液中含深红棕色溴单质,可以采用蒸馏或分液的方法分离.
解答 解:(1)将生成的硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀从溶液中除去用过滤的方法;氯化钠和盐酸的混合溶液得到氯化钠晶体,可以用蒸发结晶的方法,除去溶液中的氯化氢和水,
故答案为:过滤;蒸发结晶;
(2)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)Mg(OH)2 和Ca(OH)2 两种沉淀中氢氧化镁溶解度更小,可以加入 MgCl2 使Ca(OH)2 转化为 Mg(OH)2 沉淀,
故答案为:MgCl2;
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,该反应的化学方程式:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑,
故答案为:MgCl2•6H2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl↑+5H2O↑;
(5)①氯气具有氧化性,其氧化性强于溴单质,氯气能氧化溴离子,反应实质为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Br-═Br2+2Cl-;
②步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素;
故答案为:富集溴元素;
③溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;生成的两种酸都是强酸,对设备腐蚀较严重,所以要解决的主要问题是设备被腐蚀问题,
故答案为:强酸对设备的严重腐蚀;
④( I)控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,同时避免污染环境,最后进行尾气吸收,由于溴单质是一种强氧化剂,易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,
故答案为:Br2腐蚀橡胶;
( II)为制取较纯净的溴单质,应该控制b的温度,以便使溴被蒸馏,再经过冷凝得到溴单质,
故答案为:控制温度计b的温度,并收集59℃时的馏分;
( III)溴的沸点是59℃,溴蒸气冷凝后得到溴单质,溴单质是深红棕色,溴和水的沸点不同、溴在水中的溶解度小于在有机溶剂中的溶解度,所以可以采用蒸馏或分液的方法分离,
故答案为:深红棕色;分液(或蒸馏 ).
点评 本题以海水资源综合利用为载体考查了氧化还原反应、物质的分离和提纯、工艺流程等知识点,能从整体上把握工艺流程,知道物质间的反应、每一步的目的,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氮 | B. | 硒 | C. | 铬 | D. | 铜 |
| A. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |

| A. | 固体2是氧化铁 | |
| B. | X与足量的热浓硝酸反应有NO2和CO2生成 | |
| C. | 溶液甲中可能含有Fe3+ | |
| D. | X的化学式可以表示为Fe3C2 |
⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法,将上述物质的序号填入表格里的编辑框处:
| 分类标准 | 能导电 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ③⑤⑥⑨⑩ | ④ |
(3)⑨的电离方程式为Al2(SO4)3=2Al3++3SO42-.将34.2g ⑨冷却后溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)②与⑧发生反应的化学方程式为:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.