题目内容
16.下列有关化学用语中最能体现氮原子核外电子运动状态的是( )| A. | 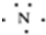 | B. |  | ||
| C. |  | D. | 1s22s22p3 |
分析 A.为电子式,表示最外层;
B.表示出N原子的原子轨道,各轨道中的电子数,以及电子的自旋方向;
C.为原子结构示意图,只表示分两个电子层,各层容纳电子数;
D.表示N原子的原子轨道,以及各轨道中的电子数,不能表示电子自旋方向.
解答 解:A.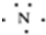 为电子式,表示最外层,不能体现氮原子核外电子运动状态,故A不选;
为电子式,表示最外层,不能体现氮原子核外电子运动状态,故A不选;
B. 表示出N原子的原子轨道,各轨道中的电子数,以及电子的自旋方向,所以能说明原子核外电子运动状态,故B选;
表示出N原子的原子轨道,各轨道中的电子数,以及电子的自旋方向,所以能说明原子核外电子运动状态,故B选;
C. 为原子结构示意图,只表示分两个电子层,各层容纳电子数,不能体现氮原子核外电子运动状态,故C不选;
为原子结构示意图,只表示分两个电子层,各层容纳电子数,不能体现氮原子核外电子运动状态,故C不选;
D.1s22s22p3表示N原子的原子轨道,以及各轨道中的电子数,不能表示电子自旋方向,能体现氮原子核外电子运动状态,故D不选;
故选:B.
点评 本题考查了原子核外电子的运动状态,题目涉及电子式、原子结构示意图、电子排布式、电子排布图,题目难度不大.

练习册系列答案
相关题目
12.下列关于Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2颜色相同 | |
| B. | Na2O和Na2O2都是碱性氧化物 | |
| C. | Na2O与Na2O2都能用于漂白,杀菌、消毒 | |
| D. | 阴阳离子的个数比均为1:2 |
7.工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:

(1)已知:N2(g)+O2(g)=2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1(a、b、c均为正值)
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{2}$(2a-2b+3c)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.05 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
上表中a、b、80%三者的大小关系为80%<a=b或80%<a<b.(填“>”、“=”、“<”、“无法比较”)
(5)在图2中画出(4)中T1温度下2mol N2和4mol H2在1L容器中反应,3小时达平衡前后过程中N2和NH3的物质的量浓度随时间的变化曲线图.

(1)已知:N2(g)+O2(g)=2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1(a、b、c均为正值)
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{2}$(2a-2b+3c)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.05 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
| 时间 N2的转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
(5)在图2中画出(4)中T1温度下2mol N2和4mol H2在1L容器中反应,3小时达平衡前后过程中N2和NH3的物质的量浓度随时间的变化曲线图.
4.在同温同压条件下,甲容器中的NH3和乙容器中H2的所含的氢原子个数相等,则这个容器的体积比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
11.下列对强、弱电解质的描述,不正确的是( )
| A. | 强电解质是指在水溶液中能完全电离的电解质 | |
| B. | 在水溶液中离子浓度小的电解质为弱电解质 | |
| C. | 在水溶液中只能部分电离的电解质为弱电解质 | |
| D. | 强酸、强碱和绝大部分盐类为强电解质 |
8.下列叙述正确的是( )
| A. | 若0.1mol•L-1的醋酸溶液pH=a,将其稀释10倍后,溶液的pH=b,则a+1>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下,若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7;则NaOH溶液的pH=11 |
5.下列物质中,不能使紫色石蕊试液变成无色的是( )
| A. | Cl2 | B. | NaClO | C. | Na2O2 | D. | NaOH |
6.下列过程或现象与盐类的水解无关的是( )
| A. | NaHCO3做发酵粉时加入柠檬酸后效果更好 | |
| B. | CaCO3的饱和溶液pH约为9.3 | |
| C. | 0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L | |
| D. | 加热氯化铁溶液的颜色变深 |