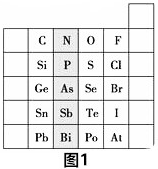
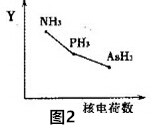
题目内容
12.已知25℃下,醋酸溶液中存在下列平衡:CH3COOH?CH3COO-+H+试回答下述问题:(1)该电离平衡的平衡常数的表达式为$\frac{c(CH{\;}_{3}COO{\;}^{-})•c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$.
(2)25℃下的K值小于 50℃下的K值(填“大于”,“等于”或“小于”);
(3)当向该溶液中加入一定量的盐酸时,K值不变(填“变大”,“变小”或“不变”);
(4)以下现象能说明醋酸是弱电解质的有ACE;
A.等浓度等体积的醋酸及盐酸溶液中,盐酸的pH值较小
B.某醋酸溶液的导电能力很差
C.醋酸溶液中存在醋酸分子
D.醋酸能与水以任意比例混合
E.质量和形状相同的锌粒在同温下分别与相同物质的量浓度的盐酸和醋酸反应,开始时醋酸产生H2速率慢.
分析 (1)电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商;
(2)弱电解质的电离中吸热的过程,升高温度,平衡向电离方向移动,电离平衡常数增大,据此判断;
(3)电离平衡常数只与温度有关;
(4)强弱电解质的本质区别是电解质的电离程度,部分电离的电解质是弱电解质,只要能说明醋酸部分电离就能证明醋酸是弱电解质,可以根据其强碱盐的酸碱性、根据相同物质的量浓度的溶液导电性强弱、根据一定物质的量浓度的醋酸溶液的pH大小判断等,据此分析解答.
解答 解:(1)电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商,对于平衡:CH3COOH?CH3COO-+H+有K=$\frac{c(CH{\;}_{3}COO{\;}^{-})•c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$,
故答案为:$\frac{c(CH{\;}_{3}COO{\;}^{-})•c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$;
(2)弱电解质的电离中吸热的过程,升高温度,平衡向电离方向移动,电离平衡常数增大,所以25℃下的K值小于50℃下的K值,
故答案为:小于;
(3)向醋酸溶液中加入盐酸,温度不变,则醋酸的电离平衡常数不变,
故答案为:不变;
(4)A.等浓度等体积的醋酸及盐酸溶液中,盐酸的pH值较小,盐酸中氢离子浓度大于醋酸,则证明醋酸部分电离,为弱电解质,故A正确;
B.溶液的导电能力与溶液中离子浓度有关,强电解的溶液当浓度很稀时导电能力也可能很差,故B错误;
C.醋酸溶液中存在醋酸分子,则证明醋酸部分电离,为弱电解质,故C正确;
D.醋酸能与水以任意比例混合,不能则证明醋酸的电离程度,故D错误;
E.质量和形状相同的锌粒在同温下分别与相同物质的量浓度的盐酸和醋酸反应,开始时醋酸产生H2速率慢,说明醋酸中氢离子浓度小于盐酸,则证明醋酸部分电离,为弱电解质,故E正确;
故选ACE.
点评 本题考查电离平衡常数的有关计算、强弱电解质的判断,注意平衡常数只与温度有关,与溶液是酸碱性无关,明确强弱电解质的根本区别是解本题关键,注意不能关键电解质的溶解性强弱判断,为易错点,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | K+、Na+、OH${\;}^{_}$、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$ | |
| B. | Ca2+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$、Cl-、NH${\;}_{4}^{+}$ | |
| C. | MnO${\;}_{4}^{-}$、Fe2+、Fe3+、Cu2+、SiO${\;}_{3}^{2-}$ | |
| D. | NO${\;}_{3}^{-}$、H+、Fe2+、SO${\;}_{4}^{2-}$、I- |

(1)已知:N2(g)+O2(g)=2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1(a、b、c均为正值)
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{2}$(2a-2b+3c)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.05 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
| 时间 N2的转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
(5)在图2中画出(4)中T1温度下2mol N2和4mol H2在1L容器中反应,3小时达平衡前后过程中N2和NH3的物质的量浓度随时间的变化曲线图.
| A. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
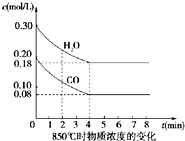 在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图:
在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生反应生成CO2和H2并放出热量,CO和H2O浓度变化如图: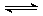 CO2+H2
CO2+H2