题目内容
2.研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)CO(g)+2H2(g)$\stackrel{一定条件}{→}$CH3OH(g).
(2)一定条件下,NO2和SO2 反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是B.(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1mol SO2,同时生成1mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为$\frac{8}{3}$;
(3)工业常用Na2CO3饱和溶液回收NO、NO2气体:NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为1:7.
分析 (1)根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
(2)平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;计算平衡时各物质的浓度,可计算平衡常数;
(3)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答 解:(1)以CO与H2为原料,在一定条件下均可合成甲醇:CO(g)+2H2(g)$\stackrel{一定条件}{→}$CH3OH(g);
以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g) $\stackrel{一定条件}{→}$CH3OH(g))+H2O,
以CO与H2为原料,产物只有一种,符合符合“绿色化学”的思想,
故答案为:CO(g)+2H2(g)$\stackrel{一定条件}{→}$CH3OH(g);
(2)A.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误;
B.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故B正确;
C.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;
D.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故D错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{C(S{O}_{3})C(NO)}{c(N{O}_{2})C(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}{a}^{2}}{\frac{a}{5}×\frac{6a}{5}}$=$\frac{8}{3}$,
故答案为:B;$\frac{8}{3}$;
(3)设NO的物质的量是x,NO2的物质的量是y,则
$\left\{\begin{array}{l}{x+\frac{y-x}{2}=\frac{2.24}{22.4}}\\{32x+24(y-x)=4.4}\end{array}\right.$
解得:x=$\frac{1}{40}$,y=$\frac{7}{40}$;即一氧化氮和二氧化氮的物质的量之比为:$\frac{1}{40}$:$\frac{7}{40}$=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
点评 本题考查绿色化学、化学平衡的标志、平衡常数的计算以及物质的量的相关计算,综合性较强,难度中等.

| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| A. | 物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液、水的电离程度的大小顺序是①>②>③ | |
| B. | 将100mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(NH4+)/c (NH3•H2O)先增大再减小 | |
| D. | 等物质的量的二元弱酸H2X与其钾盐K2X-的混合液中:c(K+)=c(H2X)+c(HX-)+c(X2-) |
| A. | 等于5.0克 | B. | 小于5.0克 | C. | 大于5.0克 | D. | 无法判断 |
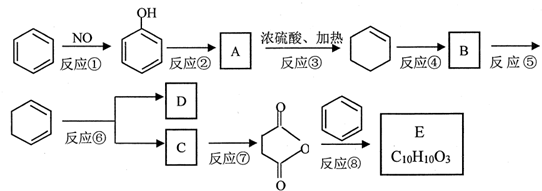
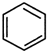 +(CH3CO)2O→
+(CH3CO)2O→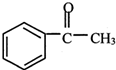 +CH3COOH
+CH3COOH ; B
; B
 直接制取
直接制取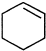 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.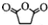 +
+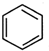 →
→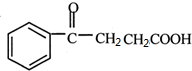 .
.