题目内容
9.已知某烃的相对分子质量为84,该烃的分子式为C6H12.分析 已知某烃的相对分子质量为84,利用余商法计算该烃的C、H原子数,从而确定该烃的分子式.
解答 解:某烃相对分子质量为84,利用商余法,分子中最大碳原子数目为:$\frac{84}{14}$=6,
含H原子为$\frac{84-12×6}{1}$=12,即该烃分子含有6个C原子、12个H原子,
所以该烃的分子式为C6H12,
故答案为:C6H12.
点评 本题考查了有机物分子式的确定,题目难度不大,明确商余法在确定烃的分子式中应用,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
19.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间判断空气中的含汞量,其反应为:4CuI+Hg=Cu2Hgl4+2Cu2,下列说法正确的是( )
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
4.下列有关六方最密堆积与面心立方最密堆积的说法中正确的是( )
| A. | 六方最密堆积是最密堆积,面心立方最密堆积不是最密堆积 | |
| B. | 两者都是最密堆积,其中六方最密堆积是一、三、五…各层球心重合,二、四、六…各层球心重合;面心立方最密堆积是四、五、六…层分别和一、二、三…球心重合 | |
| C. | 原子晶体一般都采用六方最密堆积或面心立方最密堆积 | |
| D. | 只有金属晶体才可能采用六方最密堆积或面心立方最密堆积 |
14.下列叙述正确的是( )
| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
1.25℃时,0.1mol/L盐酸与0.1mol/L K2CO3溶液等体积混合,下列说法正确的是( )
| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
14.下表是元素周期表的一部分,完成下列有关问题:
(1)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同),最活泼的非金属元素是F,最不活泼的元素是Ar.
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
15. 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
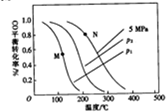
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |


 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: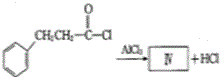
 .
. .
. .
.