题目内容
6.某化学兴趣小组在研究原电池工作原理时,设计了如图所示的装置:用导体、绝缘体制成两根杠杆,然后如图组装.杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液 (实验过程中不考虑铁丝反应及两边浮力的变化).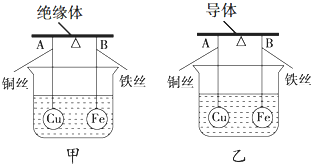
(1)一段时间后,小组成员发现甲乙两装置中的杠杆均发生偏向.甲装置中A端升高;乙装置中B端升高.(填“A”或“B”)
(2)小组成员分析后发现,造成偏向不同的原因是乙装置(填“甲”或“乙”)组成了原电池.请写出该原电池的正极反应式:Cu2++2e-=Cu.
分析 (1)甲装置中铁将溶液中铜离子转化成铜覆盖在铁表明,导致Fe的一边质量增大;乙装置中形成的原电池,铁为负极,铜为正极,铁电极失去电子、铜电极表明析出铜,据此判断质量变化及A、B的高度变化;
(2)根据(1)的分析可知,乙装置形成了原电池,铜为正极,铜离子在正极得到电子生成铜单质.
解答 解:(1)甲装置中没有形成原电池,铁将溶液中铜离子转化成铜覆盖在铁表明,导致Fe的一边质量增大,则甲装置中A升高、B降低;
乙装置中形成了原电池,铁为负极,铜为正极,铁电极失去电子导致铁电极质量减小、铜电极表明析出铜导致铜电极质量增加,则乙装置中A端下降、B端升高,
故答案为:A;B;
(2)甲装置用的是绝缘体,所以不会形成原电池,乙装置中用的是导体,形成了原电池,铁为负极,铜为正极,正极发生还原反应,铜离子得到电子生成铜,电极反应式为:Cu2++2e-=Cu,
故答案为:乙;Cu2++2e-=Cu.
点评 本题考查了原电池及其工作原理,题目难度中等,明确原电池形成条件为解答关键,注意掌握原电池工作原理,能够正确书写电极反应式,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
1.25℃时,0.1mol/L盐酸与0.1mol/L K2CO3溶液等体积混合,下列说法正确的是( )
| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
14.下表是元素周期表的一部分,完成下列有关问题:
(1)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同),最活泼的非金属元素是F,最不活泼的元素是Ar.
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
1.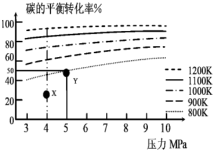 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )
 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )| A. | 上述逆反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为 | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者氢气的转化率高 |
11.下列各种说法中,不正确的是( )
| A. | 物质的量浓度均为0.1mol•L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液、水的电离程度的大小顺序是①>②>③ | |
| B. | 将100mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中(NH4+)/c (NH3•H2O)先增大再减小 | |
| D. | 等物质的量的二元弱酸H2X与其钾盐K2X-的混合液中:c(K+)=c(H2X)+c(HX-)+c(X2-) |
18.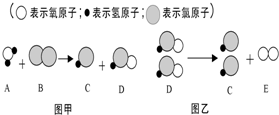 自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:根据以上图示判断下列说法错误的是( )
自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:根据以上图示判断下列说法错误的是( )
 自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:根据以上图示判断下列说法错误的是( )
自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:根据以上图示判断下列说法错误的是( )| A. | 图乙的反应是分解反应 | |
| B. | D物质代表着氧化物 | |
| C. | 图甲的化学反应方程式为:Cl2+H2O═HCl+HClO | |
| D. | 由图乙可总结出:反应前后元素的种类不改变 |
15. 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
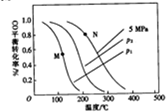
(2)以投料比=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
(2)以投料比=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |
16.某有机物的结构简式为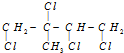 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
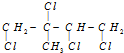 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,3-丁二烯 | ||
| C. | 1,3-丁二烯 | D. | 1,4-二氯-2-甲基-2-丁烯 |



 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: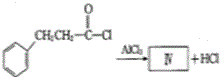
 .
. .
. .
.