题目内容
2.获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动.(1)光导纤维是一种能高质量传导光的玻璃纤维,利用光缆通讯,能同时传输大量信息.制造光纤电缆的主要原材料的化学式是SiO2,它属于无机非金属材料.
(2)信息产业的核心材料是高纯度的硅,高纯度的单晶硅生产方法之一:HCl、Cl2H2
SiO2$\stackrel{C}{→}$Si(粗硅)$\stackrel{HCl、Cl_{2}}{→}$SiHCl3(沸点31.5℃)$\stackrel{H_{2}}{→}$Si$\stackrel{气相沉积法}{→}$超纯硅(多晶硅)单晶硅
近代用得较多的另一种方法(之二)是:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅.单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好.
根据上述信息回答以下问题:
①从方法一生产单晶硅的过程看,由碳还原得到的硅为何还要进一步处理?由C还原SiO2得到的单质硅不纯
②写出方法二中,生产高纯硅的两个化学反应方程式:
I4HCl+Mg2Si═2MgCl2+SiH4↑.IISiH4$\frac{\underline{\;高温\;}}{\;}$Si+2H2.
分析 (1)光导纤维主要成分是SiO2;是无机非金属材料;
(2)①用碳在高温下还原二氧化硅可制得含少量杂质的粗硅;
②根据题意结合质量守恒定律可以完成该化学方程式的书写.
解答 解:(1)光导纤维的成分是SiO2,是无机非金属材料;故答案为:SiO2;无机非金属;
(2)①由C还原SiO2得到的单质硅含少量杂质,故答案为:由C还原SiO2得到的单质硅不纯;
②I.为硅化镁和盐酸的反应,该化学方程式为:4HCl+Mg2Si═2MgCl2+SiH4↑;反应II为硅烷在加热的条件发生的分解反应,该化学方程式为:SiH4$\frac{\underline{\;高温\;}}{\;}$Si+2H2反应;
故答案为:4HCl+Mg2Si═2MgCl2+SiH4↑;SiH4$\frac{\underline{\;高温\;}}{\;}$Si+2H2.
点评 本题考查化学方程式的书写,题目难度不大,注意书写化学方程式的步骤,可以简记为“写、配、标、注”四个字.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.设NA为阿伏伽德罗常数,下列关于1L0.2mol•L-1的Ba(NO3)2溶液正确的说法是( )
| A. | 2L溶液中阴阳离子总数为0.8NA | |
| B. | 500mL溶液中的Ba2+离子浓度为0.2mol•L-1 | |
| C. | 500mL溶液中的NO3-离子总数为0.2NA | |
| D. | 500mL溶液中的NO3-浓度为0.2mol•L-1 |
13.下列物质中,既不与亚硫酸反应又不与SO2反应的是( )
| A. | H2S | B. | O2 | C. | NaOH | D. | S |
10.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
17.钠在自然界中主要的存在形式是( )
| A. | 单质 | B. | 氧化物 | C. | 氢氧化物 | D. | 盐 |
7.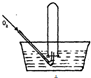 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
14.在化学反应中,会发生变化的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 质量数 |
11.在A?B+C反应中,温度每升高10℃,反应速率增大到原来的4倍,现将反应体系的温度由12℃升高到42℃,反应速率增加到原来的( )
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
12.研究性学习小组利用下列有关装置进行探究实验,回答相关问题.
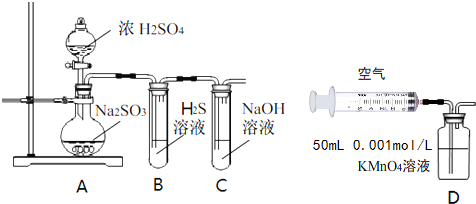
(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室制备SO2的空气,当溶液刚好褪色,停止实验.该小组的实验目的是测定实验室空气中SO2含量.

(1)写出A中的反应化学方程式Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是没有打开分液漏斗的上口活塞或分液漏斗上口活塞上的凹槽没有与分液漏斗上的小孔连通,导致无法与外界大气连通.
(3)装置B中的溶液出现浑浊,该实验证明SO2具有氧化性性.
(4)实验后,测定装置C中溶液呈碱性.溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种意见成立.选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |