题目内容
(6分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答 下列问题: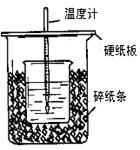
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、
无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”);所求中和热_______ (填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失。(3)偏小 (4)相等;(5)偏小;
解析试题分析:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒;(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失。(3)大烧杯上如不盖硬纸板,就会有一部分的热量散失,使求得的中和热数值偏小;(4)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行实验,由于碱稍微过量,放出的热量按照HCl来计算;如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,则酸过量,放出的热量按照NaOH来计算,热量要比第一次多;但是所求中和热不会因为反应的物质的多少而改变,因此二者相等;(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,由于NH3·H2O是弱电解质,电离需要吸收热量,使测得的中和热的数值偏小。
考点:考查中和热的测定的有关知识。

下列有关说法正确的是
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 |
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.反应物X和Y的总能量一定小于生成物M和N的总能量 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
| A.该反应为吸热反应 |
| B.A物质能量一定低于C物质能量 |
| C.该反应只有在加热条件下才能进行 |
| D.反应物的总能量高于生成物的总能量 |
(12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
| 化学键 | H—H | O=O | H—O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | H2O | CO | CO2 | H2 |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
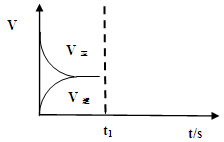
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
 CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;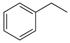 (g)
(g)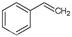 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。