��Ŀ����
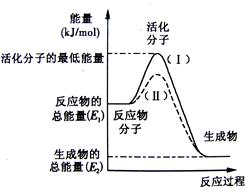
��12�֣���1���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2 + O2 = H2O�� ��֪�÷�ӦΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ������±���
| ��ѧ�� | H��H | O��O | H��O |
| ����kJ/mol | 436 | 496 | 463 |
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���Fe��Cu��Ũ���ṹ��ԭ��أ������� ���Cu����Fe������ ��Zn��Ag��ϡ���ṹ��ԭ��أ��������� ��Ӧ�����������ԭ�������������Һ������������ �����������������������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ�У�һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9 g��������ͨ���ĵ��ӵ����ʵ����� mol��
��3��һ���¶��£���3 molA�����1mol B����ͨ��һ�ݻ��̶�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)��B(g)
 xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ ��
xC(g)����Ӧ1minʱ���ʣ��1.8molA��C��Ũ��Ϊ0.4mol/L����1min�ڣ�B��ƽ����Ӧ����Ϊ ��XΪ ������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ�� 0.8mol/L������ڣ�С�ڻ���ڡ���������֪��ƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0������p0��p����ʾ��ƽ��ʱ��Ӧ��A��ת����Ϊ ��
��1��A�� 242 �� ��2�� Cu ����ԭ�� ��; 0.2��
��3��0.2mol/(L.min) �� 2�� С�ڣ� 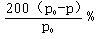 ��
��
���������������1���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2 + O2 = H2O�� ��֪�÷�ӦΪ���ȷ�Ӧ����Ӧ������������������������������ͼ����ȷ��ʾ�÷�Ӧ�������仯����A��������1molˮ���Էų�������2��463��436��496��1/2=242(KJ)����2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���Fe��Cu��Ũ���ṹ��ԭ��أ�������������Fe��Ũ�����лᷢ���ۻ������Ի�Խ�����Cu����������Zn��Ag��ϡ���ṹ��ԭ��أ�����ǿ��Zn��������Ag���������������Ϸ���H+�õ����ӱ�Ϊ������������ԭ��Ӧ������ͬ�ֵ����ų⣬���ֵ���������ԭ�������Һ������������ɽ϶��������������ͬ��ͭ����п���õ������Ӻ����CuSO4��Һ��Zn������������������һ��ʱ���ȡ��ϴ�����������������������Ϊ12.9 g�����ݷ�Ӧ����ʽZn+Cu2+=Zn2++Cu,��֪ÿ����65gп���������Ͳ���64g��Cu�������缫�������129g,ת�Ƶ���2mol,���ڶ���������Ϊ12.9 g�����Ե�����ͨ���ĵ��ӵ����ʵ�����0.2mol����3�����������֪��Ӧ����A1.2mol����ͬʱ������B0.4mol,����v(B)= 0.4mol��2L��1min=0.2mol/(L.min); v(C)= 0.4mol/L��1min=0.4mol/(L.min); v(B)��v(C)=1:2.����x="2;" ����Ӧ��2min�ﵽƽ�⣬��Ϊ��Ӧ��������̶��������ڽ��У����ŷ�Ӧ�Ľ��У����ʵ�Ũ�Ȼ��С�����ʻ����������ǰ1minC�仯Ũ����0.4mol/L,��1min��C��Ũ�ȱ仯��С��0.4mol/L���������Ӧ��2min�ﵽƽ�⣬ƽ��ʱC��Ũ��<0.8mol/L, ������̶����ܱ������ڽ��еĻ�ѧ��Ӧ�������������ѹǿ֮�ȵ������ǵ����ʵ����ıȡ� 3A(g)��B(g) 2C(g)��
2C(g)��
��Ӧ��ʼʱ��������ʵ�����mol�� 3 1 0
��Ӧ������������ʵ�����mol x x/3 2x/3
ƽ��ʱ��������ʵ�����mol�� 3-x 1��x/3 2x/3
[(3-x) +(1��x/3)+2x/3]��(3+1)= p/p0��
���x=6(p0��p)/ p0.
����A��ת������(x��3)��100%={[6(p0��p)/ p0]��3]} ��100%=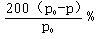 .
.
���㣺����ԭ��ط�Ӧԭ������Ӧ�ȡ�����ʽϵ����ȷ������ѧ��Ӧ���ʡ����ʵ�ת���ʵļ����֪ʶ��

������������ȷ����
| A�������������ڿ�������ѧ��ʴ�����䰵 |
| B������ȼ�ϵ����һ�ֽ���ѧ��ת��Ϊ���ܵ�װ�� |
| C�����ý������Ը��������Һ����ֽ������������������Ư���� |
| D�����ϴ���ȫ��ʧ�衱���г�ʹ�ó�Ϊ���У�����Ϊ���ϴ�����ռ�����أ������Խ��� |
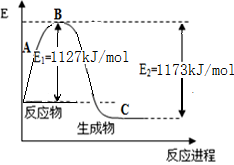
���з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ����
| A��Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ |
| B����Ƭ��ϡ���ᷴӦ |
| C�������ڿ�����ȼ�� |
| D�����ȵĽ�̿��CO2��Ӧ |
��ҵ��Ҳ������CO2��H2��Ӧ�Ƶü״�����2��105Pa��300��������£�����44g CO2��6g H2ǡ����ȫ��Ӧ��������״���ˮ���ų�49.5kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
ij��ʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���
�Իش��������⣺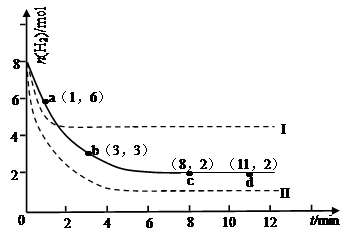
��1��a������Ӧ���� ������ڡ����ڻ�С�ڣ��淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ���������� ����С���� ��
| A��0��1min |
| B��1��3min |
| C��3��8min |
| D��8��11min |
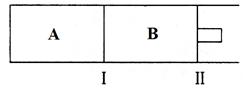
��4�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� ������II��Ӧ��ʵ�������ı��� ��