题目内容
A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色.取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少.组成这五种物质的离子有(各物质所含的离子均不相同)
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- 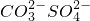 HCO3- HCO3- |
①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失.据此推断它们是A________;B________;C________;D________;E________.
Na2CO3 Ba(OH)2 Mg(HCO3)2 AlCl3 Fe2(SO4)3
分析:A、B、C、D、E、均为可溶于水的固体,结合离子性质判断CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会消失现象,所以推断D为AlCl3;E、Fe2(SO4)3.
解答:A、B、C、D、E、均为可溶于水的固体,结合离子性质和离子共存的特征分析判断,CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;D可能为AlCl3 或Al2(SO4)3;E则可能为Fe2(SO4)3 或FeCl3;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会消失现象,所以推断D为AlCl3;E、Fe2(SO4)3;
故答案为:Na2CO3;Ba(OH)2;Mg(HCO3)2 ;AlCl3;Fe2(SO4)3.
点评:本题考查了物质检验的方法,物质性质的分析判断,反应现象的综合应用,熟知物质性质,理解离子共存是解题关键、
分析:A、B、C、D、E、均为可溶于水的固体,结合离子性质判断CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会消失现象,所以推断D为AlCl3;E、Fe2(SO4)3.
解答:A、B、C、D、E、均为可溶于水的固体,结合离子性质和离子共存的特征分析判断,CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;D可能为AlCl3 或Al2(SO4)3;E则可能为Fe2(SO4)3 或FeCl3;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会消失现象,所以推断D为AlCl3;E、Fe2(SO4)3;
故答案为:Na2CO3;Ba(OH)2;Mg(HCO3)2 ;AlCl3;Fe2(SO4)3.
点评:本题考查了物质检验的方法,物质性质的分析判断,反应现象的综合应用,熟知物质性质,理解离子共存是解题关键、

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.