题目内容
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.(1)A、B、C、D、E元素最高价氧化物对应水化物的酸性由强到弱的顺序为(用化学式表示)
(2)E元素的常见阴离子的核外电子排布式为
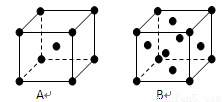
(3)右图是E和Fe形成的晶体FeE2的最小单元“晶胞”,FeE2晶体中阴、阳离子数之比为
分析:A、B、C、D、E五种短周期元素,A、C、E三元素的原子核外均只有2个未成对电子,则外围电子排布为ns2np2或ns2np4,由于原子序数依次增大,各元素对应的单质均为固体,则A为碳元素、C为Si元素、E为S元素,故D为P元素;B、E元素的原子序数之和等于C、D元素的原子序数之和,则B的原子序数=14+15-16=13,则B为Al,据此解答.
解答:解:A、B、C、D、E五种短周期元素,A、C、E三元素的原子核外均只有2个未成对电子,则外围电子排布为ns2np2或ns2np4,由于原子序数依次增大,各元素对应的单质均为固体,则A为碳元素、C为Si元素、E为S元素,故D为P元素;B、E元素的原子序数之和等于C、D元素的原子序数之和,则B的原子序数=14+15-16=13,则B为Al,
(1)非金属性S>P>C>Si>Al,故最高价氧化物对应水化物的酸性由强到弱的顺序为H2SO4>H3PO4>H2CO3>H2SiO3>Al(OH)3;
A、C两元素对应的气态氢化物分别为CH4、SiH4,二者都形成分子晶体,SiH4的相对分子质量较大,分子间作用力较强,其沸点较高,
故答案为:H2SO4>H3PO4>H2CO3>H2SiO3>Al(OH)3;SiH4、CH4;
(2)E元素的常见阴离子为S2-,其核外电子排布式为1s22s22p63s23p6;A、C两种元素形成的化合物为SiC,属于原子晶体;D元素的最高价含氧酸根离子PO43-、PO3-,PO43-中P原子价层电子对数=4+
=4,P原子采取sp3杂化,PO3-中P原子价层电子对数=3+
=3,P原子采取sp2杂化,
故答案为:1s22s22p63s23p6;原子晶体;sp3 或sp2;
(3)由晶胞结构可知,晶胞中S22-离子数目=4×
=1、Fe2+离子数目=4×
=1,故FeS2晶体中阴、阳离子数之比为1:1,FeS2中含有的化学键类型为离子键、共价键,
故答案为:1:1;离子键、共价键.
(1)非金属性S>P>C>Si>Al,故最高价氧化物对应水化物的酸性由强到弱的顺序为H2SO4>H3PO4>H2CO3>H2SiO3>Al(OH)3;
A、C两元素对应的气态氢化物分别为CH4、SiH4,二者都形成分子晶体,SiH4的相对分子质量较大,分子间作用力较强,其沸点较高,
故答案为:H2SO4>H3PO4>H2CO3>H2SiO3>Al(OH)3;SiH4、CH4;
(2)E元素的常见阴离子为S2-,其核外电子排布式为1s22s22p63s23p6;A、C两种元素形成的化合物为SiC,属于原子晶体;D元素的最高价含氧酸根离子PO43-、PO3-,PO43-中P原子价层电子对数=4+
| 5+3-2×4 |
| 2 |
| 5+1-2×3 |
| 2 |
故答案为:1s22s22p63s23p6;原子晶体;sp3 或sp2;
(3)由晶胞结构可知,晶胞中S22-离子数目=4×
| 1 |
| 4 |
| 1 |
| 4 |
故答案为:1:1;离子键、共价键.
点评:本题考查物质结构与性质,涉及元素推断、元素周期律、核外电子排布、杂化轨道、化学键、晶胞结构等,难度不大,推断元素是解题的关键,(2)中杂化方式判断为易错点,学生容易忽略偏磷酸根.

练习册系列答案
相关题目