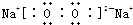题目内容
元素A、B、C、D、E、F的原子序数依次增大,前五种元素为短周期元素,F元素为第四周期元素,且D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):

其中,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;无论是含有D元素还是含有F元素,相邻的乙与丙或丙与丁两两间互不发生化学反应.请回答下列问题:
(1)写出化合物甲的电子式: .
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 .
(3)复盐是指由2种或2种以上阳离子和一种阴离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐戊的化学式 .化合物己是制备复盐戊的必须物质之一,工业上常用氧气、水和FE2来制取,并得到E的高价态化合物,请写出工业上由FE2制取化合物己的化学方程式 .
(4)EC2是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.图2是某啤酒样品不同时间段总EC2的变化情况,请运用所学的知识解释啤酒样品中总EC2随时间变化的主要原因是 .
(5)由A、C元素组成化合物庚和A、E元素组成的化合物辛,式量均为34.其中庚的熔沸点高于辛,其原因是: .

其中,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;无论是含有D元素还是含有F元素,相邻的乙与丙或丙与丁两两间互不发生化学反应.请回答下列问题:
(1)写出化合物甲的电子式:
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
(3)复盐是指由2种或2种以上阳离子和一种阴离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐戊的化学式
(4)EC2是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.图2是某啤酒样品不同时间段总EC2的变化情况,请运用所学的知识解释啤酒样品中总EC2随时间变化的主要原因是
(5)由A、C元素组成化合物庚和A、E元素组成的化合物辛,式量均为34.其中庚的熔沸点高于辛,其原因是:
分析:元素A、B、C、D、E、F的原子序数依次增大,前五种元素为短周期元素,F元素为第四周期元素,且D、F为常见金属元素.A元素原子核内只有一个质子,则A为H元素;元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,气体摩尔质量=22.4L/mol×0.759g?L-1=17g/mol,该气体甲为NH3,则B为N元素;C元素原子的最外层电子数是其电子层数的3倍,则C原子核外有2个电子层,最外层电子数为6,则C为O氧元素;E与C同主族,则E为S元素; D、F为常见金属元素,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,D为Al元素,则乙为AlO2-、丙为Al(OH)3、丁为Al3+;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F元素为第四周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,据此解答.
解答:解:元素A、B、C、D、E、F的原子序数依次增大,前五种元素为短周期元素,F元素为第四周期元素,且D、F为常见金属元素.A元素原子核内只有一个质子,则A为H元素;元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,气体摩尔质量=22.4L/mol×0.759g?L-1=17g/mol,该气体甲为NH3,则B为N元素;C元素原子的最外层电子数是其电子层数的3倍,则C原子核外有2个电子层,最外层电子数为6,则C为O氧元素;E与C同主族,则E为S元素; D、F为常见金属元素,均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,D为Al元素,则乙为AlO2-、丙为Al(OH)3、丁为Al3+;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F元素为第四周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,
(1)化合物甲为NH3,其电子式为: ,
,
故答案为: ;
;
(2)化合物甲的水溶液为氨水溶液,与D元素对应的金属阳离子为Al3+,反应的离子方程式为:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+;
均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F元素为第四周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,乙与丁在溶液中发生反应的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+;Fe+2Fe3+=3Fe2+;
(3)由A为H、B为N、C为O、E为S、F为Fe元素组成的一种具有还原性的复盐,说明含有亚铁离子和铵根离子,复盐戊的化学式(NH4)2Fe(SO4)2等;
化合物己是制备复盐戊的必须物质之一,工业上常用氧气、水和FeS2来制取,得到S的高价态化合物,己为FeSO4,还生成硫酸,工业上由FeS2制取FeSO4的化学方程式为:2FeS2+7O2+2H2O=2FeSO4+2H2SO4,
故答案为:(NH4)2Fe(SO4)2等;2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
(4)由图可知,啤酒样品中总SO2随时间变化减少,原因是:二氧化硫与啤酒中溶解氧发生反应,转化为H2SO4而逐渐减少,
故答案为:二氧化硫与啤酒中溶解氧发生反应,转化为H2SO4而逐渐减少;
(5)由H、O元素组成化合物庚和H、S元素组成的化合物辛,式量均为34,则庚为H2O2、辛为H2S,H2O2分子间存在氢键,沸点比硫化氢高,
故答案为:H2O2分子间存在氢键.
(1)化合物甲为NH3,其电子式为:
 ,
,故答案为:
 ;
;(2)化合物甲的水溶液为氨水溶液,与D元素对应的金属阳离子为Al3+,反应的离子方程式为:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+;
均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,F元素为第四周期元素,则F为Fe元素,乙为Fe单质、丙为Fe2+、丁为Fe3+,乙与丁在溶液中发生反应的离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+;Fe+2Fe3+=3Fe2+;
(3)由A为H、B为N、C为O、E为S、F为Fe元素组成的一种具有还原性的复盐,说明含有亚铁离子和铵根离子,复盐戊的化学式(NH4)2Fe(SO4)2等;
化合物己是制备复盐戊的必须物质之一,工业上常用氧气、水和FeS2来制取,得到S的高价态化合物,己为FeSO4,还生成硫酸,工业上由FeS2制取FeSO4的化学方程式为:2FeS2+7O2+2H2O=2FeSO4+2H2SO4,
故答案为:(NH4)2Fe(SO4)2等;2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
(4)由图可知,啤酒样品中总SO2随时间变化减少,原因是:二氧化硫与啤酒中溶解氧发生反应,转化为H2SO4而逐渐减少,
故答案为:二氧化硫与啤酒中溶解氧发生反应,转化为H2SO4而逐渐减少;
(5)由H、O元素组成化合物庚和H、S元素组成的化合物辛,式量均为34,则庚为H2O2、辛为H2S,H2O2分子间存在氢键,沸点比硫化氢高,
故答案为:H2O2分子间存在氢键.
点评:本题考查元素及无机物的推断、常用化学用语、元素化合物的性质、氢键等,难度较大,侧重对学生综合能力的考查,需要学生具备扎实的基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.