题目内容
A、B、C、D、E是五种原子序数依次递增的短周期主族元素,已知:其中只有一种是金属素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素的原子质子数的2倍;B的最外层电子数是电子层数的2倍;C、A可形成二种常见的液态化合物甲和乙,且相对分子质量乙比甲大16.
(1)E元素的名称: ;D的原子结构示意图:
(2)化合物乙中含有的化学键: ;
(3)A单质与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,从原子经济角度,应选用B、C的化合物是 (填化学式);
已知CO(g)+
O2(g)═CO2(g);△H=-283KJ/mol
H2(g)+
O2(g)═H2O(g)△H=-242KJ/mol
CH3OH(g)+
O2+2H2O(g)═CO2(g)+2H2O;△H=-651KJ/mol 写出A与所选化合物合成甲醇的热化学方程式: .
(4)EC2与C、D形成化合物发生氧化一还原反应的化学方程式: .
(1)E元素的名称:
(2)化合物乙中含有的化学键:
(3)A单质与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,从原子经济角度,应选用B、C的化合物是
已知CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
CH3OH(g)+
| 3 |
| 2 |
(4)EC2与C、D形成化合物发生氧化一还原反应的化学方程式:
分析:A、B、C、D、E是五种原子序数依次递增的短周期主族元素,C、E同主族,且E元素原子质子数是C元素的原子质子数的2倍,则C为O元素、E为S元素;结合原子序数可知B处于第二周期,B的最外层电子数是电子层数的2倍,则B原子最外层电子数为4,故B为C元素;C、A可形成二种常见的液态化合物甲和乙,且相对分子质量乙比甲大16,则A为H元素,甲为H2O、乙为H2O2;A和D元素的原子最外层电子数相同,且只有一种是金属素,可推知D为Na元素,据此解答.
解答:解:A、B、C、D、E是五种原子序数依次递增的短周期主族元素,C、E同主族,且E元素原子质子数是C元素的原子质子数的2倍,则C为O元素、E为S元素;结合原子序数可知B处于第二周期,B的最外层电子数是电子层数的2倍,则B原子最外层电子数为4,故B为C元素;C、A可形成二种常见的液态化合物甲和乙,且相对分子质量乙比甲大16,则A为H元素,甲为H2O、乙为H2O2;A和D元素的原子最外层电子数相同,且只有一种是金属素,可推知D为Na元素,
(1)由上述分析可知,E为硫元素;D为Na元素,其原子结构示意图为: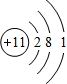 ,
,
故答案为:硫;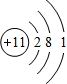 ;
;
(2)化合物乙为H2O2,分子中H原子与O原子之间形成极性键,O原子之间形成非极性键,
故答案为:极性键、非极性键;
(3)H2与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,甲醇中C原子与O原子数目之比为1:1,从原子经济角度,应选用B、C的化合物是CO;
已知:①CO(g)+
O2(g)═CO2(g);△H=-283KJ/mol
②H2(g)+
O2(g)═H2O(g)△H=-242KJ/mol
③CH3OH(g)+
O2+2H2O(g)═CO2(g)+2H2O;△H=-651KJ/mol
根据盖斯定律,①+②×2-③得:CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol,
故答案为:CO;CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol;
(4)SO2与O、Na形成化合物发生氧化还原反应,该化合物为Na2O2,二者反应生成硫酸钠,反应的化学方程式为:SO2+Na2O2=Na2SO4,
故答案为:SO2+Na2O2=Na2SO4.
(1)由上述分析可知,E为硫元素;D为Na元素,其原子结构示意图为:
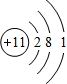 ,
,故答案为:硫;
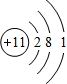 ;
;(2)化合物乙为H2O2,分子中H原子与O原子之间形成极性键,O原子之间形成非极性键,
故答案为:极性键、非极性键;
(3)H2与B、C的一种化合物可合成一种新型汽车动力燃料甲醇,甲醇中C原子与O原子数目之比为1:1,从原子经济角度,应选用B、C的化合物是CO;
已知:①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
根据盖斯定律,①+②×2-③得:CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol,
故答案为:CO;CO(g)+2H2(g)=CH3OH(g)△H=-116KJ/mol;
(4)SO2与O、Na形成化合物发生氧化还原反应,该化合物为Na2O2,二者反应生成硫酸钠,反应的化学方程式为:SO2+Na2O2=Na2SO4,
故答案为:SO2+Na2O2=Na2SO4.
点评:本题考查结构性质位置关系应用、化学键、热化学方程式、氧化还原反应等,难度不大,推断元素是解题的关键,注意基础知识的全面掌握.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
