题目内容
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是____。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
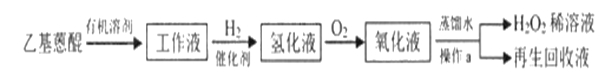
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为____。
②操作a是____。
③再生回收液的成分是____。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为 ___,该样品中H2O2的物质的量浓度为______。
【答案】BaO2+H2SO4===BaSO4↓+H2O21:1萃取分液有机溶剂乙基蒽醌2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O0.1250mol/L
【解析】
(l)易溶于水的BaO2和稀硫酸反应生成H2O2和BaSO4沉淀,发生反应的化学方程式是BaO2+H2SO4=BaSO4↓+H2O2;(2) ①根据反应原理可知,蒽醌法制备双氧水理论上消耗的原料是氧气和氢气,根据双氧水的化学式可知,原料的物质的量之比为1:1;②加入蒸馏水后进行操作a得到稀双氧水和再生回收液,根据流程原理再生回收液应该为乙基蒽醌,故操作是将乙基蒽醌从水中分离出来,应采用萃取分液;③再生回收液的成分是有机溶剂,乙基蒽醌;(3)双氧水在酸性条件下与KMnO4发生氧化还原反应,锰元素化合价由+7价降到+2价,O元素由-1价升高到0价,根据得失电子守恒、电荷守恒和原子守恒配平,滴定时发生反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O,根据反应可计算,样品中H2O2的物质的量浓度为![]() 。
。

【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为____________。
(2)⑨在元素周期表中的位置是________________________。
(3)用电子式表示④元素与⑦元素形成化合物的过程________________________。
(4)可以用来验证④⑤两元素金属性强弱的实验是_______________________。(填字母代号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)均比较这两种元素的气态氢化物的稳定性
(5)⑥和⑦阴离子还原性较强的是(填微粒符号):____________用一个置换反应证实这一结论(写化学方程式)____________________________________。