题目内容
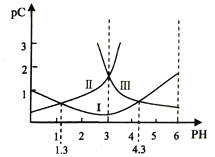
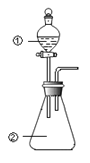
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D
【答案】C
【解析】
A、盐酸先与NaOH反应,不立即产生气泡。A现象不合理;B、先发生Al3++4OH―=AlO2―+2H2O,后Al3++3AlO2―+6H2O=4Al(OH)3 ↓,先无沉淀,后产生沉淀,B现象不合理;C、2Fe3++2I―=I2+2Fe2+ ,I2遇到淀粉呈蓝色。C正确;D、Fe2+ 会被氧化成Fe3+ ,生成Fe(OH)3 ,呈红褐色,D不正确。故选C。

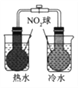
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D
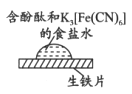
【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水
| 放置一段时间后,生铁片上出现如图所示“斑痕”。边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈
|
下列对实验现象解释不正确的是
A. 中心区为蓝色的原因是铁失电子被氧化,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀
B. 边缘处为红色的原因是发生吸氧腐蚀,生成了OH-,使溶液中c(OH-)>c(H+)
C. 边缘处为红色的原因是发生析氢腐蚀,消耗了H+,打破了水的电离平衡,使c(OH-)>c(H+)
D. 交界处出现铁锈的原因是4Fe2++8OH-+O2+2H2O=4Fe(OH)3,Fe(OH)3分解得到铁锈