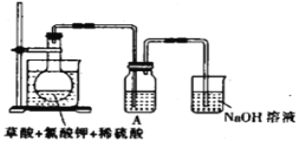
题目内容
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
【答案】D
【解析】
本题主要考查钠的重要化合物。A.钠元素焰色反应呈黄色;
B.正盐碳酸钠的溶解度大于酸式盐碳酸氢钠;
C.碳酸氢钠受热易分解生成碳酸钠;
D.根据碳守恒分析解答。
A.钠元素焰色反应呈黄色,所以两者焰色反应均为黄色,故A正确;
B.正盐碳酸钠的溶解度大于酸式盐碳酸氢钠,故B正确;
C.碳酸氢钠受热易分解生成碳酸钠,所以可以用加热的方法除去Na2CO3固体中的NaHCO3杂质,故C正确;
D.NaHCO3和Na2CO3都与足量盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,NaHCO3+HCl=NaCl+H2O+CO2
,NaHCO3+HCl=NaCl+H2O+CO2![]() ,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,故D错误。
,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,故D错误。

【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
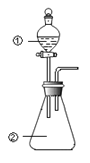
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。