题目内容
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
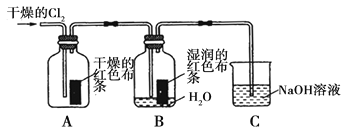
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
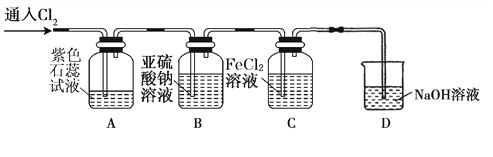
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
【答案】(12 分)
(1)①干燥的有色(或 A 中)布条不褪色,湿润的有色(或 B 中)布条褪色(1 分);
Cl2无漂白性,Cl2与水反应生成的 HClO 有漂白性(1 分)
②Cl2+ H2O = H++ Cl-+ HClO (2 分)
③吸收氯气,防止环境污染(1 分)0.1(2 分)
(2)①溶液先变为红色,然后褪色。(1 分)
②2Fe2++Cl2===2Fe3++2Cl-(2 分)
③SO32-+Cl2="==" SO42-+2Cl-(2 分)
【解析】试题分析:(1)①该实验目的是探究Cl2的漂白性,干燥的氯气没有漂白性,Cl2+ H2O =HCl+HClO,HClO具有漂白性,所以通入Cl2 后,观察到的现象是干燥的有色(或 A 中)布条不褪色,湿润的有色(或 B 中)布条褪色。根据现象可得出的结论是Cl2无漂白性,Cl2与水反应生成的 HClO 有漂白性;②Cl2+ H2O =HCl+HClO,HClO为弱电解质,离子方程式为Cl2+ H2O = H++ Cl-+ HClO;③氯气有毒,所以C装置的作用是吸收氯气,防止环境污染;
(2)①本实验的目的是探究Cl2的氧化性,Cl2+ H2O = H++ Cl-+HClO,溶液含有的H+能使紫色石蕊变红色,HClO具有强氧化性,能使紫色石蕊褪色,所以实验开始后,观察装置A 中的现象是溶液先变为红色,然后褪色;
②Fe2+具有还原性,被氯气氧化为Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
③滴加氯化钡溶液,有白色沉淀生成,说明溶液中的SO32-被氧化为SO42-,反应的离子方程式为SO32-+Cl2= SO42-+2Cl-。

 全能练考卷系列答案
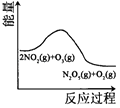
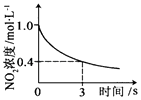
全能练考卷系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A | B | C | D |
|
|
|
|
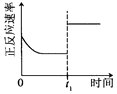
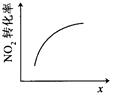
升高温度,平衡常数增大 | 0~3s内,反应速率为: | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O3) |
A.A
B.B
C.C
D.D