题目内容
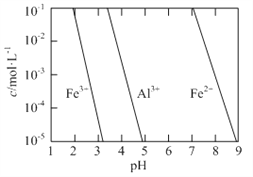
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
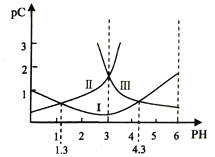
A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
【答案】C
【解析】
随PH增大,C(H2A)减小、C(HAˉ)先增后减、C(A2-)增大;根据图示,曲线Ⅰ表示c(HAˉ)、曲线Ⅱ表示c(H2A)、曲线Ⅲ表示c(A2-);根据图示,pH=4时,c(HAˉ)>c(A2-),故A错误;调节溶液PH的方法不确定,所以c(H2A)+c(HAˉ)+c(A2-)不一定是定值,故B错误;根据图示c(H2A)= c(HAˉ)时,pH=1.3,所以Ka1=![]() = 10-1.3,故C正确;根据图示c(A2-)= c(HAˉ)时,pH=4.3,Ka2=
= 10-1.3,故C正确;根据图示c(A2-)= c(HAˉ)时,pH=4.3,Ka2=![]() ,HAˉ的水解常数=
,HAˉ的水解常数=![]() ,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
电解:酸式弱酸盐NaHA溶液酸碱性的判断方法:若HAˉ的电离平衡常数大于HAˉ的水解平衡常数,溶液呈酸性;若HAˉ的电离平衡常数小于HAˉ的水解平衡常数,溶液呈碱性。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
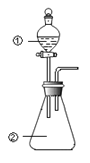
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
A. A B. B C. C D. D